一 、基礎概念與名詞介紹
1. 浪 v.s. 流
浪(Wave)以及流(Current)這兩個詞在玩家間常會被混著使用,但在探討流體狀態時兩者其實是不太一樣的概念。
浪的常用英文「Wave」其實就是物理學中的波。波的本質其實是能量的傳遞,而所謂的浪通常是指水以週期性的運動來傳遞能量,而最直觀的例子便是你在海邊所看到那一波一波的海浪。在海洋中的浪多半是由風所提供能量,因此主要發生在表層,而隨著接觸到陸地,這些長波會被壓縮和攤平而讓水反覆的被來回移動。不過由於主要被傳遞的是能量而非分子本身所以單純的浪在長距離移動物質時的效率並不高。
流則是指水分子持續移動的狀態。相對於波,流對於長距離移動物質有更好的效率。在海洋中的水流可以到達很大的規模,甚至可以帶著許多的養分或生物等物質在大洋間移動,也就時我們常聽到的洋流或環流(Gyre)。除了大範圍的洋流外,海浪在接觸到障礙後所碎裂出的部分也提供了淺海區域一些局部的水流,而這些流同樣也提供了這些環境一定的物質交換。
2. 流量
流量指的是單位時間內所能移動的水之體積。流量的主要會被用在一些需要計算水體置換效率的用途,如過濾、溫控、或添加等。由於方便量化且多數市售造流設備也都有標示,流量往往是最常被玩家討論的一個參數,然而其意義也僅是能把多少水從吸水口丟到出水口而已,並不見得能完全代表一顆幫浦的輸出狀況。
3. 流速
如果要探討水流對生物及環境的直接影響,流速會是一個比較常用的參數。顧名思義,流速指的就是水流的速度,你可以想像為單位時間內一個小顆粒在水中被移動的距離。「移動」的概念也就意味著能確實的帶來及帶走物質,因此流速這個參數相對比較能體現生物實際面對的水流環境。實際在缸中影響流速的因子很多,因此多數市售造流設備並不會特別標示,而若要測量的話除了使用昂貴的流速儀外亦可透過簡單的錄影或計時觀察缸中的小顆粒(飼料或粉塵等)在特定時間內的移動距離來做粗略的估算。
4. 何謂亂流?
許多玩家間的討論都會提到海水缸需要所謂的「亂流」,但這到底是什麼意思呢? 在流體力學中,流體有兩大類型的流動狀態: Laminar Flow以及Turbulent Flow。Laminar Flow常被翻作層流,其定義為一平行移動不同層間不會互相混合的穩定流動狀態;而Turbulent Flow則常被翻譯作亂流、湍流、或紊流,而其定義也正好相反,指的是壓力、流速、流向等性質都混沌無法預測的流。
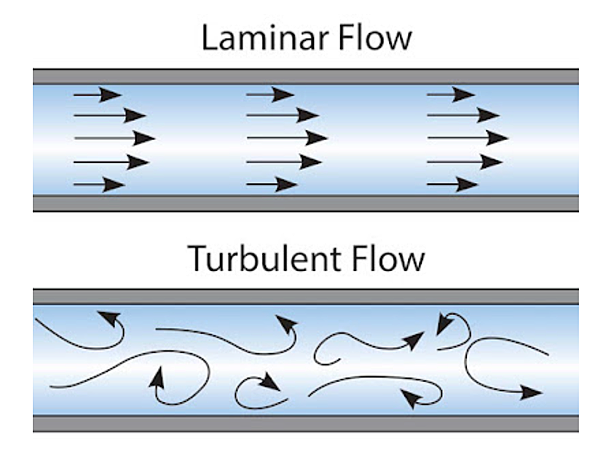
圖一、Laminar Flow v.s. Turbulent Flow (圖片來源: Laminar Flow v.s. Turbulent Flow)
不過既然亂流是無法預測的那究竟要如何以比較科學的方式去判別呢?1883年Osborne Reynolds在管子中進行了一系列流體實驗並根據結果整理出了一個公式來判斷觀察到的流究竟是層流還是亂流,而這個公式的計算結果便是著名的雷諾數(Reynolds number),而當雷諾數越高,流體的狀態就越亂。在圖二中的Re便是雷諾數,而ρ為流體密度、u為流速、L為特徵長度(就是系統的規模)、μ則為流體之黏滯性、 ν 為流體的運動黏滯性(密度與黏滯性比值)。
這乍看之下可能會讓人有點摸不著頭緒,但在我們的用途下其實幾乎可以簡化到剩流速和特徵長度這兩個因子,而藉此我們就能得到一個結論: 流速越快、流動範圍越大,流就越亂。

圖二、Reynolds number 公式 (圖片來源: Reynolds number)
5. 邊界層(Boundary layer)與物質交換
了解了一些水流的基本性質後,我們再來聊聊水接觸到其他物體後的現象。物體表面會和水產生摩擦力進而產生一層相對停滯的水,這也就是所謂的邊界層(Boundary layer)。常見的邊界層定義包含了Momentum Boundary Layer和Concentration Boundary Layer兩種。前者指的是物體表面因摩擦力而造成流速衰減的水層,後者則是以水中物質的濃度變化作定義,而從這兩種定義我們可以知道邊界層會造成流速的下降以及物質混合的效率下降。
邊界層的厚度則很大程度是取決於雷諾數,也就是水流有多亂,而若雷諾數越高則邊界層的厚度也會隨之下降[35],這也是亂流的一大重要性。
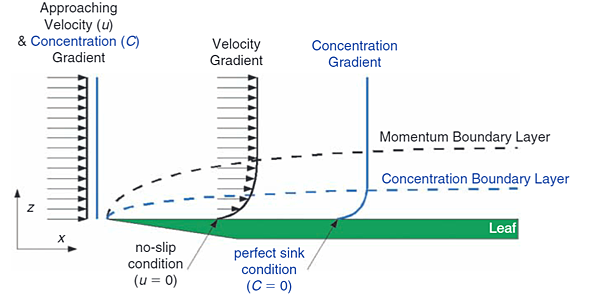
圖三、 Momentum Boundary Layer和Concentration Boundary Layer (圖片來源: Mass transport in aquatic environments)
二 、水流對飼養生物的影響
1. 自然環境中的水流
不像某些淡水棲地可能水體幾乎是靜止的,絕大多數的海洋環境都有一定程度的水流,而生存在不同區域的生物則會對水流有不同的偏好與適應能力。
圖四中可以看到一個典型的珊瑚礁在不同區域的流(Uc)與浪(Uw)之比例。首先從鄰靠外海的Forereef開始,這裡主要會是由表層的洋流或是深海的湧升流所帶動的持續性水流;到了水深較淺的Reef crest時,強勁的浪開始主導使得這邊成為防波堤一般的區域;更後方的Reef flat由於許多的浪已被抵銷掉使的流與浪的比例趨近相同;而在能量被一路消耗後最後的Lagoon區則又會隨著水深增加而轉為以流為主的緩和環境。
而除了洋流與風力外,潮汐亦會對這些環境的水流產生影響。每天漲潮和退潮的週期會造成持續數小時的大規模反向水流並使水位發生變化,而這也使珊瑚礁環境在漲潮與退潮時不同的水流狀態。在漲潮時由於水位上升,外海的物質與能量會更容易被帶到珊瑚礁內部; 而在退潮時的低水位則會讓外海的浪與流更容易被抵銷掉使得水流變得相對緩和,甚至在一些潮池內可能完全靜止[30, 31, 43]。
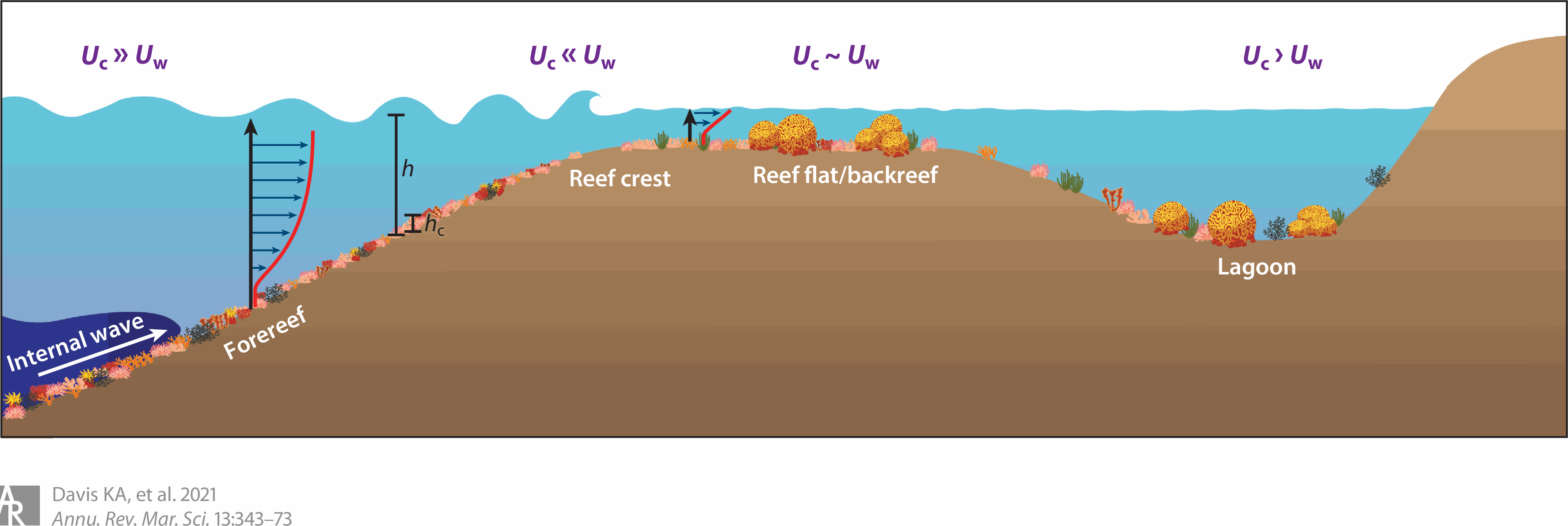
圖四、不同珊瑚礁區域的流與浪 (圖片來源: Turbulence and Coral Reefs)
2. 魚類
由於海洋環境中的水很少會是絕對靜止的,絕大多數的海水魚都還是比較適應有一定水流的環境。適當的水流能增加魚類的運動進而使肌肉量上升、減少體脂[44]、並使成長率與代謝速率提升[36]。不過長時間過強的水流亦有可能增加魚類的緊迫,尤其是一些游泳能力較差的底棲魚[28]。
水流亦對許多魚類的攝食行為有一定的影響,例如一些以浮游生物為食的魚在適當的流速下反而可能有更高的攝食率[24]並節省自身所花的能量[21],但一些以珊瑚或藻類為食的定點攝食魚類則可能因太強的流而影響攝食行為,如Lenihan等人便觀察到在水流變化率大的珊瑚礁區域中以珊瑚為食的魚對珊瑚的下口率有顯著下降[26] 。此外魚類之間的領域性與打鬥行為在弱流下也可能更明顯,而反之在強流下一些魚類亦可能表現出更多的群遊行為[17]。
3. 珊瑚
(1) 物質交換
珊瑚的生理構造相當簡單,並不像魚類等構造較複雜的動物一樣有鰓這樣的特化的高表面積氣體交換器官或是心血管這樣的循環系統,因此環境中的的水流會直接影響到他們交換氧氣或二氧化碳等物質的效率。
如同在運動後耗氧量增加我們會透過喘氣來獲得更多氧,充足的水流同樣也可以藉由降低邊界層厚度提升珊瑚的呼吸作用效率。部分的珊瑚如一些Xeniidae(八爪)的成員可以藉由觸手的規律收縮來主動製造水流來維持基本的生理機能[23],這幾年的研究亦有發現石珊瑚的表面其實有許多微小的纖毛可以透過不斷旋轉製造垂直的水流以降低邊界層厚度(圖五)[37, 40],然而這些手段的效率多半還是比主動呼吸差了點,因此許多研究結果仍然顯示水流與呼吸作用有很大的相關性[4, 5, 6, 38, 42]。
珊瑚的光合作用效率亦受到水流很大的影響。共生藻在行光合作用的同時也會產生許多ROS(Reactive Oxygen Species),而這些ROS對生物的組織會造成很大的傷害,同時也是造成珊瑚白化的一大原因,這也是為何絕大多數光合作用生物都會有Photoinhibition的現象,也就是當到了一定的光強度時光合作用效率反而會下降。充足的水流便可藉由增加這些ROS的來除效率來減緩Photoinhibition進而使珊瑚可以在更強的光下繼續行光合作用,而從圖七也可以看到在較高的流速下光合作用的效率也可以達到更高的數值[6]。此外許多野外的研究亦發現在水流較強的區域珊瑚也更不容易白化,其中一部分的原因正是來自這個移除ROS的效果[6, 20, 33, 34]。
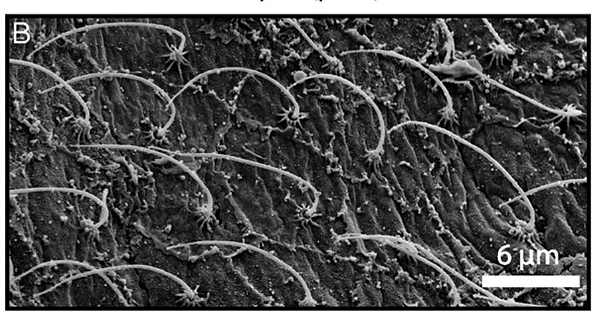
圖五、石珊瑚體表的纖毛 (圖片來源: Vortical ciliary flows actively enhance mass transport in reef corals)
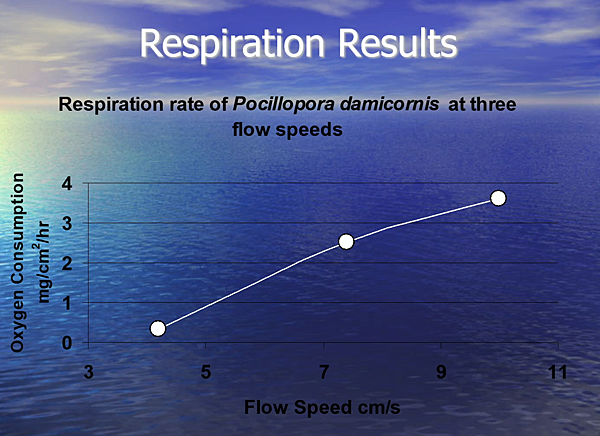
圖六、水流流速與圖釘珊瑚(Pocillopora damicornis)之呼吸作用效率成正相關 (圖片來源: Water Flow is More Important for Corals Than Light)
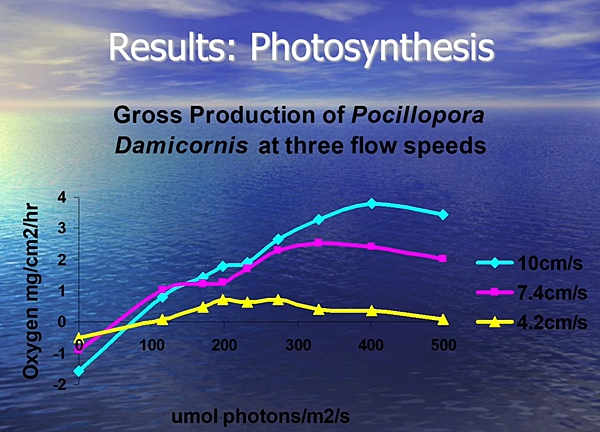
圖七、不同水流流速與圖釘珊瑚(Pocillopora damicornis)之光合作用效率曲線 (圖片來源: Water Flow is More Important for Corals Than Light)
(2) 攝食與廢物移除
絕大多數的珊瑚成體為固著生長的動物,因此水流同樣也扮演著帶來食物以及帶走排遺和分泌物的角色。不同種類的珊瑚有不同的偏好攝食流速,戴昌鳳博士與林明炤博士的研究發現水螅體較大的海樹在弱一點的水流環境(7~9cm/s)有比較好的攝食效率,而水螅體小的海樹種類則在強流(40cm/s)下仍可正常伸展攝食[18];Levy等人發現他們所研究的龜殼腦在15cm/s的水流條件下觸手伸展的最多,而完全無水流的環境則不會伸展[27]; Wijgerde等人亦發現Galaxea fascicularis 在5~15cm/s有最好的捕食效率(圖八)[47]。
此外,珊瑚所分泌的大量黏液等代謝物以及沉積在身上的粉塵汙泥亦需透過水流來移除以維持健康。珊瑚的黏液具有運輸物質以及調控表層微生物相等作用[15, 45],但這些黏液分泌也會受到包含水流在內的環境因子調控[15, 25],而很多珊瑚(尤其是軟珊瑚)也會週期性的製造一層厚厚的黏液來移除表層的藻類與雜質[9, 48]。Lee等人的研究便發現軸孔珊瑚的黏液微生物相是會受到水流影響的,他們的結果顯示在弱流高溫下珊瑚身上的病原菌會增加,但是在強水流下的珊瑚微生物相卻維持得很穩定[25];而Wu等人亦發現在強水流環境下珊瑚的黏液分泌量與環境中的細菌量都有下降都趨勢[46]。

圖八、Galaxea fascicularis 的單一水螅體(深色)及colony(淺色)在不同流速下捕食無節幼蟲的效率 (圖片來源: Water Flow Affects Zooplankton Feeding by the Scleractinian Coral Galaxea fascicularis on a Polyp and Colony Level)
(3) 生長
珊瑚的生長速率與生長型態同樣受到水流的調控。Dennison和Barnes等人的研究發現實驗室中的軸孔珊瑚在水流不足的情況下暗鈣化速率可以減少近60%而光鈣化速率則可以減少到25%[20],而諸多水缸養殖以及野外研究也都顯示許多珊瑚的生長速率和水流是有正相關的[5, 26, 32, 41]。其中Schutter等人的研究發現在水缸養殖中的Galaxea fascicularis雖然隨著水流增加成長速率也加快,但其光合作用和呼吸作用效率卻沒有顯著提升,而他們也認為這個生長速率提升的效果可能是來自於水流減少了藻類等其他競爭者或是病原的生長進而幫助了珊瑚[41]。
除了生長速率外,水流亦會影響珊瑚的生長型態。Chindapol等人發現Pocillopora verrucosa會在面向水流的方向會有更多的生長(圖九)[16],然而Bottjier對Acropora cervicornis的野外觀察反倒觀察到了在強水流下遠離水流生長的趨勢[14],因此雖然我們知道生長方向確實會受水流改變但實際會朝著哪邊則還是可能因珊瑚種類或水流強弱而影響。珊瑚的分枝多寡與粗細亦會受到水流強弱所影響,Kaandorp的研究與Nakamura和Yamasaki的研究發現Stylophora pistillata, Pocillopora damicornis, Seriatopora hysterix, Millepora alcicornis這幾種分枝狀珊瑚都會在強流下表現出更粗且更密的分枝[22, 32]。

圖九、Pocillopora verrucosa在無流(A)、弱流(BC)、與強流(DEF)下面向水流的生長狀態 (圖片來源: Modelling Growth and Form of the Scleractinian Coral Pocillopora verrucosa and the Influence of Hydrodynamics)
4. 養殖系統
(1) 水面擾動
多數封閉養殖系統都會需要某種形式的氣體交換來平衡由呼吸作用所消耗的氧氣及產生的碳酸,而水面擾動便是最常見的一個手段。就如同我們的血液會被輸入到肺中與吸入新鮮空氣接觸,養殖系統也可以藉由空氣與水的交界面來使氣體得以因為分壓差擴散,而水流便可以擾動水面增加這交界面的表面積讓擴散效率更好。此外,這一氣水界面同樣有邊界層的存在,因此良好的水流亦可藉由增加亂度(雷諾數)使變界層厚度降低增進擴散效率。
(2) 過濾與廢物排除
水流亦扮演著將廢物帶入過濾系統中的角色。一般常見的過濾器或是反應器都會利用幫浦將水打入內部處理後再回到缸中,而根據不同的需求該水流的流速可以被調整來達到最佳的接觸時間。
而在缸內營造良好的水流也同樣也是相當重要,除了讓溶解的物質濘更快的被運輸擴散外也能使糞便或殘餌等沉澱的顆粒狀廢物懸浮在水體中增加進入過濾系統的機率避免堆積在缸內的死角。
還有一點也很常被忽略,那就是我們缸內的沙石或玻璃等表面其實也都可以藉由表層或孔隙內部的生物相來行生物過濾。就好比你整個缸就是一個過濾器,甚至還可以看到一些缸子是完全沒有獨立過濾器的,因此缸內的循環造流與過濾用的循環有時也不見得是如此一刀兩斷的。
(3) 溫度平衡
無論是降溫還是加溫設備,沒有足夠的水流循環的話效率都會變得非常差。除了會嚴重的溫差外,若缸子較大亦有可能讓溫控幾乎失效甚至產生局部的熱點或冷點造成設備或缸子損壞。獨立的溫控設備通常會有廠商標示的建議流量,而若是直接置入缸內的類型如加溫棒或是分離式冷水機則需注意熱交換器周遭是否有足夠的水流持續循環。
另外水面擾動所增加的表面積亦可讓蒸發散熱的效率上升,因此若有溫度偏高的問題亦可將這點納入考量,只是若使用的為沉水式的馬達的話亦有可能反過來讓溫度上升。
三 、如何設置缸中的水流
1. 白努利定律(Bernoulli's Law)與流速
在開始談論水流的配置前我 先再補充一個流體力學的概念,也就是白努利定律。白努利定律的公式可簡化為三個部分,分別是動能/動態壓力( 1/2ρv^2 )、位能(ρgz)、靜態壓力(p),而三者的總和恆為一常數。乍聽之下也許有點難懂,但白努利定律的本質其實也就是能量守恆。舉例來說若一根水管的管徑縮小了但流量仍不變那流速自然就會增加,而既然能量往動能的部分跑了那貢獻到壓力部分的也就會變少進而使水壓下降。飛機的機翼、螺旋槳、魚類的鰭等其實都是運用這個原理以略為上傾的角度造成流速上升產生壓力差以獲得升力,而蛋白機的進氣文氏管同樣也是靠增加流速來減壓吸氣(這邊指的壓力都是指靜態壓力,而高壓水槍或是加壓水龍頭這類敘述中所提的則是動態壓力也就是這裡講的動能)。
若要將以上的觀念運用到水流配置中我們可以得到幾個重點: (1) 出水管徑變小會使流速加快 (2) 速度快的流可以藉由壓力差帶動周圍的流

白努利定律公式 (圖片來源: Bernoulli's principle)
2. 硬體設備
這邊我會著重在不同造流手段的介紹,若想瞭解不同馬達與幫浦的運作原理可以參考這篇: 水族常用的馬達種類
(1) 氣動式造流
氣動式造流的原理為利用往水中打氣製造的氣泡上浮時產生的壓力差帶動水流,是最早被用在水族飼養的造流手段。其優點在於能以低廉的成本移動大量的水體、能以單一設備同時驅動複數缸子、沒有會傷到飼養生物的葉片、且不會影響水溫,但缺點則包含了噪音以及氣泡導致的噴濺在海水中容易產生鹽漬。
現今氣動式造流在海水飼養中主要被運用在一些生物幼體的飼育以避免旋轉的葉片可能造成的損傷,此外其附帶大量氣水攪拌的功能亦會被運用在UAS藻屏(Upflow Algae Scrubber)或蛋白機等用途上。
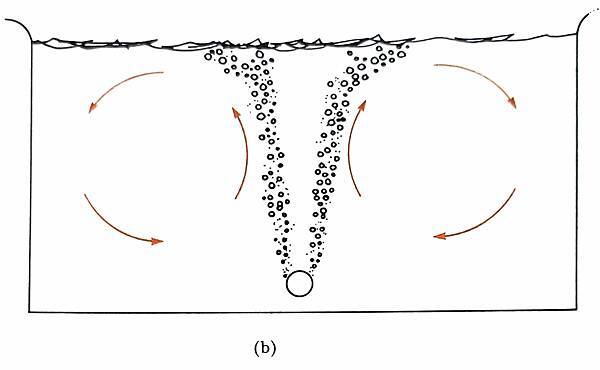
圖十、直接在缸中打氣所產生的氣動環流 (圖片來源: Captive Seawater Fishes: Science and Technology)
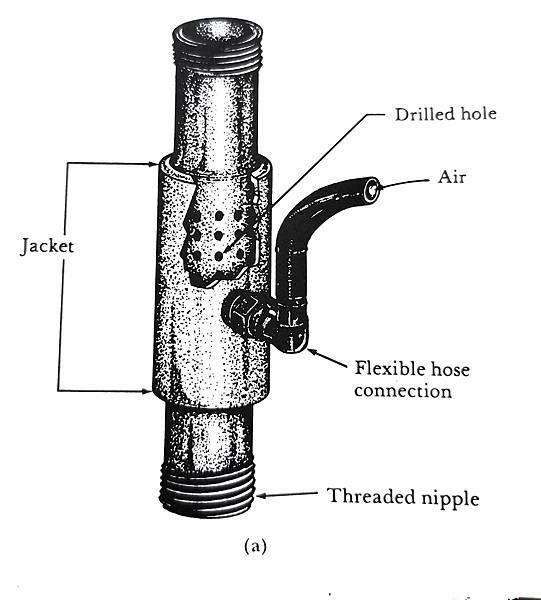
圖十一、亦可利用不同的設計來改變水流推動效率和流向,如這裡便是在入水處鑽洞使進氣得以更平均 (圖片來源: Captive Seawater Fishes: Science and Technology)
(2) 葉輪式幫浦
葉輪式幫浦的入水與出水都可接上各種管件以調整水流的方向,因此常被用來作為過濾器等設備的動力源。不過葉輪式幫浦在推動大範圍水流的效率並不如之後會提到的螺旋槳式幫浦或是恆流式幫浦,但能獨立配管這點仍有很大的優勢。
在選購時須注意不同馬達的設計,例如是設計來沉水使用、離水使用、還是皆可? 是否有流量調整功能? 能否承受持續的開關? 又或是若你想垂直上推水流的話揚程是否足夠?
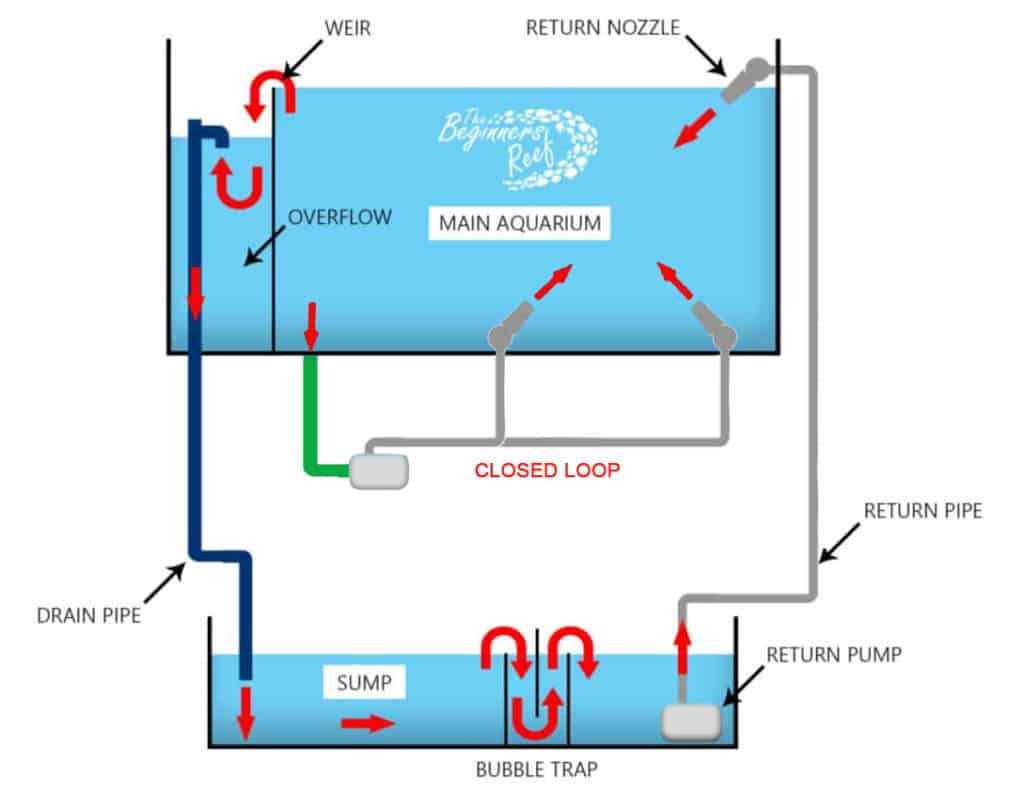
圖十二、葉輪式幫浦運用在缸子的過濾主循環(Return Pump)以及缸內造流循環(Closed Loop) (圖片來源: What is a Closed-Loop Aqaurium?)
(3) 螺旋槳式幫浦 & 恆流式幫浦
我們一般俗稱「造流馬達」或是「造浪馬達」通常就是指這兩類幫浦。螺炫獎式與橫流式幫浦移動大範圍的水流的效率相當好,而且這幾年也有了很多可以調節流量、設置不同模式、甚至定時功能的變頻產品(aka DC馬達),因此現今也成為海水缸中最常見的主缸造流選擇。
在選擇這些造流馬達時除了考慮流量與可控性外更重要的是其輸出的水流性質,而這點通常是由出水口與葉片的設計來決定。通常出水口及葉片的截面積越大則水流會越偏向廣範圍的圓錐形緩流;反之若你希望獲得比較高的流速或是想把水推得更遠就得找輸出端截面積小一點的或是在出水有一些集流設計的馬達。

圖十三、Tunze的Turbelle Stream為最早的螺獎式幫浦商品 (圖片來源: Das Tunze Turbelle® Stream Kit TS24)

圖十四、 Ecotech的Vortech將Motor移至缸外的設計減少了缸內所佔的體積與熱源,但犧牲了水流方向的調整能力 (圖片來源: Aquarium and Pond Pumps)

圖十五、橫流式幫浦的出水型態多半也屬於集中的高流速水流 (圖片來源: Gyre XF350 Cloud Edition - Pump Only (5280 GPH))
(4) Surge Device
這類型的水流裝置是利用用其他的幫浦作為動力源來將水推入一個暫時的儲水空間內,然後在水囤積到一定容量後在一次湧出提供缸內一波一波的水流,而其Surge的名字便是由此而來(如同海洋中的湧浪)。
Surge Device可以擴增原有幫浦一次帶動的水流並營造出來回的浪,不過缺點則是很佔空間且多半受限於容器大小而難以提供持續性的水流,因此主要被用在較大型的缸子內製造大規模的水體湧動或震盪。

圖十六、Wavebox是利用螺旋槳幫浦驅動的Surge device (圖片來源: Meine Erfahrungen mit der Tunze Wavebox 6208)

圖十七、"Dump bucket" surge device (圖片來源: The Reef Aquarium: Science, Art, and Technology)

圖十八、 由海洋生物學家Bruce Carlson所設計,以虹吸原理來水的Carlson Surge Device (圖片來源: Farm-Raised Corals and Marine Fish: Let's Tour the ORA® Aquaculture Facility)
(5) Switching Current Water Director (SCWD)
SCWD是利用機械式原理將單一的入水以隨機的方式分配到兩個以上的出水中以營造出持續變化的流向,而隨著流速越快,切換頻率也會越高。這個裝置的優點在於完全不需要電子元件便能讓單一一顆馬達輸出有變化的水流,但由於海水飼養中往往容易有各種鈣化或生物生長到機械式構造上使裝置失效,再加上現今已有各種方便的可控造流馬達,因此這幾年已經很少有玩家會使用了。

圖十九、Switching Current Water Director (圖片來源: The Reef Aquarium: Science, Art, and Technology)
(6) 水舞機
水舞機同樣也是用來切換水流流向的設備,不過與SCWD的差異在於水舞機是用馬達來規律的旋轉出水,因此會需要外接電源。水舞機大致分為兩類: 一種是可以接上獨立的馬達(通常就是一般螺旋槳式造流)並讓其擺動(圖二十); 另一種則是要外接配管來導入水流,並用馬達來擺動該出水端(圖二十一)。

圖二十、接上造流馬達的水舞機 (圖片來源: Sea Sweep from Sea Swirl is a new propeller pump rotating device)

圖二十一、外接配管的水舞機 (圖片來源: The Sea Sweep and Multi-Size Sea Swirl Review)
(6) 造流接頭
造流接頭為一系列利用基本的物理原理改變馬達出水的流速或流向的裝置統稱,通常會裝在主循環或Closed Loop的葉輪幫浦出水口來使用,而這邊我會簡單介紹一下幾種比較常見的類型。
首先是水流加速器(圖二十二&二十三),這類型的接頭是透過將出水的管徑縮小來提升流速(也就是白努利定律),不過回壓則有可能導致原來的流量略微下降; 而第二類則是旋轉接頭(圖二十四),這類型的接頭主要是利用機械式元件來讓出水的方向持續旋轉,但和前面提到的SCWD一樣有容易卡住的缺點; 最後則是隨機式的出水接頭(圖二十五),這種接頭就不是靠機械式原件來改變流向而是以導流設計來使出水的方向隨機變化,因此就比較不會有卡住的缺點,只是由於變化頻率快所以能帶動的水體範圍還是有限,故只有在小缸中才比較能看出效果(這點旋轉式接頭也一樣)。

圖二十二、最簡單的鴨嘴式水流加速器 (圖片來源: Water Output Nozzle Duckbill)

圖二十三、Eductor型的加速器除了單純透過縮小管竟加速水流外還額外設計了入水端讓周圍的水也可以因為壓力差被吸入,因此反而能提升缸內的循環流量數倍 (圖片來源: Sizing eductor nozzles)

圖二十四、Hydor的旋轉式接頭 (圖片來源: FLO)

圖二十五、 VCA的Random Flow Generator (圖片來源: The New Flex Series Is Here! Check out the Extremely Durable and Flexible Random Flow Generator®)
3. 設置概念
(1) 主循環/過濾循環
循環量
在很多早期的討輪中可能會看到不少建議都是倡導每小時要循環主缸的水量十幾次甚至二十次的流量,但在絕大多數的缸子中這都已經遠遠超過實際所需了。
當然啦,你實際會需要的過濾流量也會取決飼養密度與生物種類、餵食量、使用的設備與濾材、以及過濾的核心究竟是在哪裡,但即使是水產養殖等級的密度與餵食量加上又把絕大多數的過濾都放在主循環中的這種極端情況下,每小時十倍循環也已經是非常高的數值了[11, 13, 49],更不用講一般的居家海水混養缸。
另外一個導致很多玩家把主循環搞到這種程度的原因是他們將主循環與主缸內部的造流給綁在一起了。這個狀況在早期也許還說得通,因為當時也還沒有這麼多造流選擇,所以玩家缸子內唯一的馬達可能就只有主循環。只是現今已有非常多高效率的造流馬達可供選擇了,而相比之下主循環的造流效率可以說是其差無比。因此除了一些缸內水流需求不高的小缸外我是不建議將主循環納入主缸的造流內。
講了那麼多,那究竟你的缸子需要多少的主循環流量呢? 若你的飼養目標是以柏林系統為基礎、生物過濾主要仰賴主缸中的沙石的混養缸的話,那每小時4~6倍的主循環量已經非常足夠了(我的很多缸子甚至只有2~3倍而已); 而若是高密度飼養的FO缸且主要的生物濾材是放置在底缸等過濾區的話,那我會把循環量調整到10~12倍。
至於除此之外的設置就自己抓個中間值囉,但在實際選用循環馬達前也要記得將配管與垂直上推的壓損考慮進來。市面上的馬達通常會標示揚程,也就是馬達上推多少高度時會損失多少流量,只是實務上又還有配管這個因子在,因此實在很難準確預估。不過就像我前面所提的,絕大多數人其實不太需要擔心主循環不足的問題,因此通常也只需抓個大略的保險值就好。若要確認的話也可以用一個已知容量的容器(e.g. 桶子或袋子)來盛接循環的出水或入水看多久會裝滿,然後再稍微估算一下即可。
水怎麼流?
除了單純的循環量以外,另一個重點是要如何讓水流過你的過濾設備。
第一個容易被忽略的點是水面的油膜,這些漂浮的雜質除了不美觀外亦會直接影響光照的穿透與氣體交換,此外油膜也會持續吸附更多的水中雜質使其浮在水面上難以被過濾清除,因此維持水面的清潔對於飼養而言是有很多幫助的,我甚至認為能夠有效濾移除表層水的重要性遠高於在溢流隔板上開一堆洞來吸大便(水面一樣能成為水流死角!)。主缸的油膜通常由上溢流或是將過濾器進水孔接上可吸入表層水的處理器來去除,不過這點在很多傳統的缸子設計中很常被輕視,因此在購買現成缸或是訂製新缸時最好是先注意一下。
第二類型的油膜則容易囤積在底濾或側背濾缸的隔間中。這些油膜雖然比較不會礙眼但仍會造成影響氣體交換,此外也代表著你缸內其實還有一堆東西是進不了過濾內只能浮在那裏腐爛。改善方法也與主缸中的油膜相似,只是底缸區域通常比較不會有水面擾動,因此更需要營造出水位落差讓雜質們可以順著瀑布被沖入水體內,而這個自由落體的效果除了去油膜外亦可以提供一些額外的擾動增加氣體交換。
再來則是流經濾材的水流。在玩家間可能常會聽到如「強迫式過濾」或「乾溼分離」之類的用語,而這些概念不外乎就是希望濾材可以發揮最好的效果。強迫式過濾指的是將水流強制導經濾材的手法(圖二十六),雖然聽起來很炫泡但實際操作上其實也只是不要讓水往其他孔隙跑或溢出去而已,而過濾區域的截面積越小強迫的效果也會越好,因為流速會提升且水也比較沒那麼多亂跑或停滯的空間; 而乾溼分離則也算是強迫式過濾的一類,只是其利用的是重力來使水自然鄰到濾材上因此通常會用在離水使用的濾材如白棉或是滴流球(圖二十七)。
不過和循環量一樣,絕大多數人根本也不會需要那麼強的過濾效能,甚至有些人還會為了維持一點缸內養分而降低過濾效能,因此我會建議與其拘泥於各種曲折迂迴的底缸分隔設計還不如就專注在維持水流暢通減少堆積沉積物的死角即可。不過也有少部分吸附劑或向NP豆豆這種有特殊水流需求的濾材就得要多注意一下了,但若只是一般的生物濾材的話基本上不要有太誇張的厚重汙泥或生物膜堆積就不太需要擔心了。
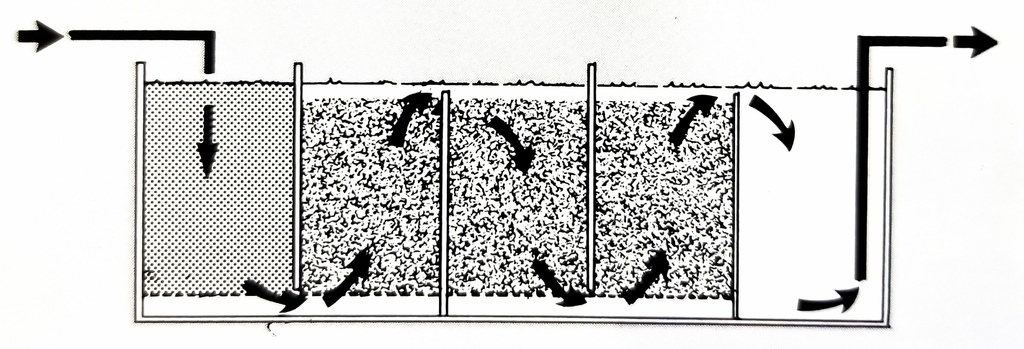
圖二十六、常見的浸水強迫式過濾設計(圖片來源: The Modern Coral Reef Aquarium, Volume 1)
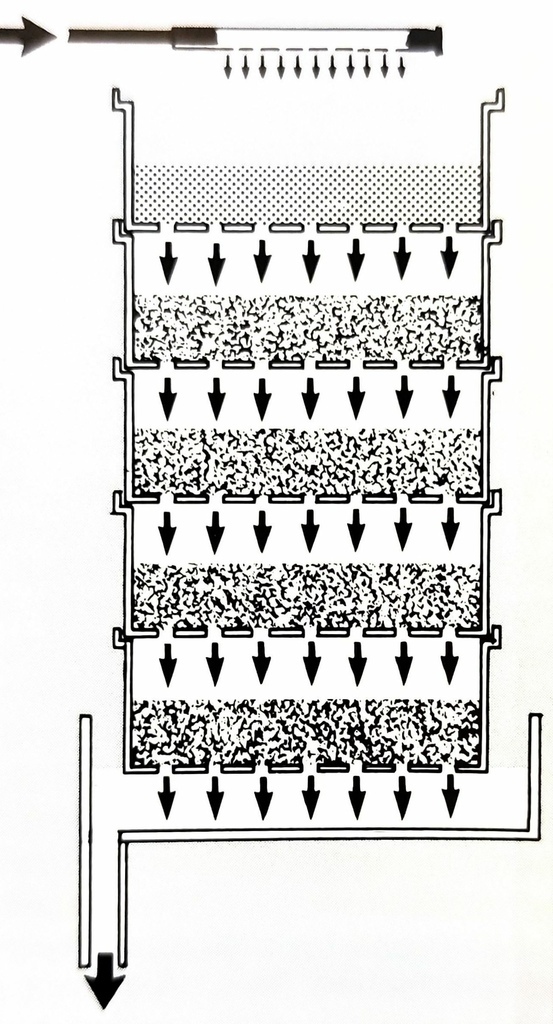
圖二十七、乾溼分離的滴流式過濾 (圖片來源: The Modern Coral Reef Aquarium, Volume 1.)
(2) 主缸造流
流速
雖然很多玩家還是會使用流量來討論主缸的造流,不過其實流速才是真正會影響到生物的參數,因此我通常會建議以此作為判斷基準。由於習性以及生長環境的差異,不同生物自然會有不同的適應流速。以魚類等有移動能力的動物來說通常越是底棲的物種對強水流的適應能力越差,反之主要活動於開放水域的種類則會偏好更快的流速。
而珊瑚的話就有比較多因子要考量了。對於有共生藻的珊瑚來說,水流很重要的一項功能便是帶走光合作用產生的氧化廢物,因此水流的強若會直接關係到珊瑚對光照甚至是溫度的承受能力。長話短說,如果你的光照越強,水流也要越強。若要比較粗略的參考值的話大約100 µmols/m/s 的中弱光照可以搭配5~10 cm/s的流速; 而400 µmols/m/s以上的強光則至少需要15~20 cm/s的流速搭配(圖二十八)[6]。
不過這些數值當然也只是給你做個初始的參考,實際飼養時還是得依生物狀況為主。而除了光照外,珊瑚本身的型態也會很大程度的影響其水流適性,例如一些組織肥厚的肉多LPS或是八爪椰花這類軟珊瑚可能就無法承受太強勁的流,反之水螅體較小的軸孔珊瑚科(Acroporidae)或鹿角珊瑚科(Pocilloporidae)SPS以及皮革系列的軟珊瑚(Sarcophytidae)則會偏好強一點的流。從雷諾數的公式中我們可以知道當受流截面積越大則水流也會越容易亂,因此大體上來說水螅體大的珊瑚確實也比較不需要那麼強的流。
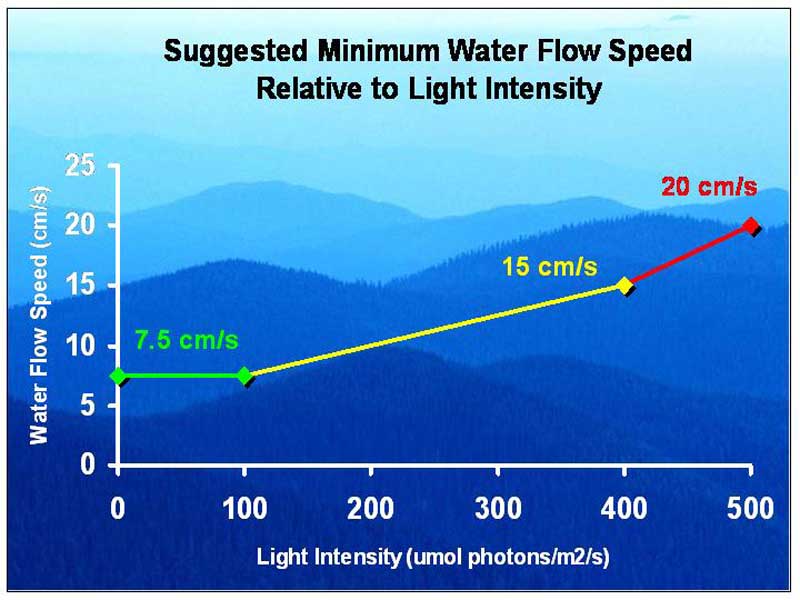
圖二十八、水流與光照的搭配建議值 (圖片來源: Water Flow is More Important for Corals Than Light)
水流環境的營造
不同的玩家也都有不同的造流偏好以及習慣,因此如何設置缸內水流其實也沒有個標準答案。這裡我會提供一些基本概念與可以嘗試的初始設置,不過實務上還是得依你的生物狀況來調整就是了。
營造環流效率最好的方式便是將你的馬達或出水口擺放在接近水面處,因為要擾動表層水的難度遠低於在底部擾動(你可以試試在水面與水底攪動一桶水的阻力就知道了),所以可以更容易的產生高流速並利用白努利定律帶動其他水。第二個重點則是沿著缸子的長邊吹,因為這樣只要能把水推到對面去自然就會有股趨勢將對面那端的水帶回來(沿短邊吹的話帶動的範圍會比較小),而只要馬達像這樣持續運轉一段時間就會讓動能堆積起來並以相當節能的方式帶動整缸水動起來。
不過這樣單方向水流長期飼養下還是容易使沉積物堆及在同樣的區域以及讓珊瑚的成長變得不對稱,因此下一個重點便是改變流向。以環流來說這點其實相當容易,只需在缸子另一端在擺一顆馬達並設置為以至少五到十分鐘以上(越大的缸需要越久)的間隔交換開就可以讓流向有交替變化了。
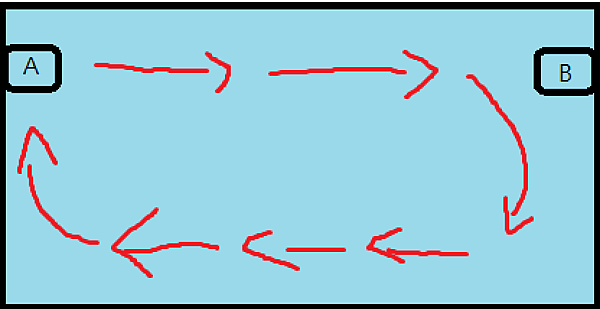
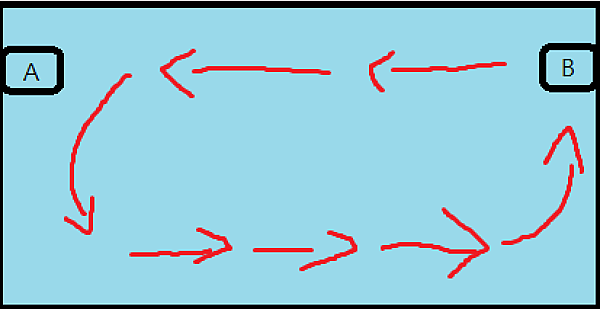
圖二十九 & 三十、由水體表面往下循環的環流缸正視圖,可透過A與B馬達的交替來切換整缸的流向
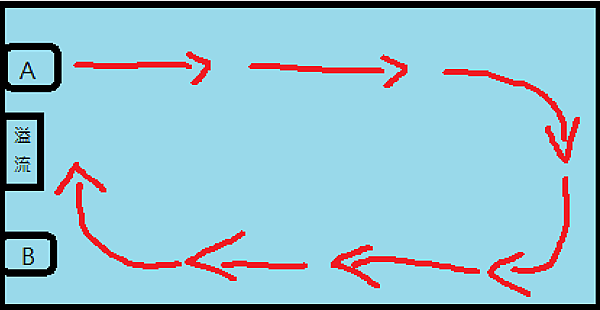
圖三十一、三面觀賞的屏風缸亦可將環流的方向改圍繞著缸子做順時鐘以及逆時鐘循環,如上面的俯視圖
早期營造湧浪會需要使用Surge device,不過目前已可透過調整馬達開關頻率與整缸水體共鳴來帶動了。這類型水流模式雖然在很多現今的可控馬達中都會看到,但其實用度其實並沒有那麼高,主要運用在輔助的造流或是以編程功能安排在一天中的特定時間執行。
透過移動對沖點來造流雖然效率不如環流,但調整的彈性就高了很多,因此也就可以更精巧的把流送到目標處。這個方法適合用在小缸、鋪細沙的缸、希望營造不同棲地的混養缸、或是養一些不喜歡持續被單向水流吹的生物,而除此之外亦可利用馬達的定時編程功能與其他水流模式搭配來針對性的改善死角而不用整天都跑同一種模式。
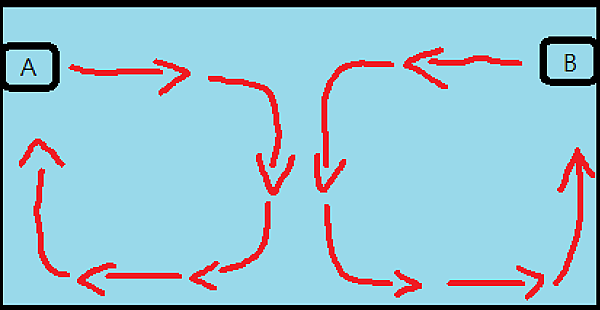
圖三十二、A與B馬達的對沖點可以透過改變兩者的相對流量來調整,例如當A的輸出由80%逐漸下調至10%時,B就可以反過來從10%逐漸上調至80%

圖三十三、這缸的尺寸為60x45x45cm,配置兩顆Tunze 6055調製30%輸出並間格約五分鐘交替開啟。由於油膜處理器在缸子後方,兩顆馬達都是稍為往斜前對角的方向吹以將油膜帶到後面,不過可以看到前端的底砂就因為持續的環流而難以維持整齊。

圖三十四、這缸的尺寸為120x60x60cm,使用兩顆Maxspect Gyre XF350以上限50%輸出的方式不斷變化流量。這缸主要是軟珊瑚,因此若長時間以單向水流吹的話很容易變得東倒西歪,所以才改成用持續變換對沖點的方式提供珊瑚所需的水流。


圖三十五 & 三十六、這缸尺寸為60x45x45cm,使用一顆捷寶MLW-10在後側底部吹。原先這缸其時僅有主循環的出水配上鴨嘴對水面吹而已,雖然對這些珊瑚種類來說是夠了但仍有很多區域會堆積粉塵,因此後來配了一顆MLW-10將後側的沉澱物吹到前面並以編程功能在不同時段跑不同模式。
四 、參考資料
1. Reynolds number Wikipedia.
2. Turbulence Wikipedia.
3. Bernoulli's principle Wikipedia.
4. Water flow is more important for corals than light. Part 1. Introduction to Gas Exchange By Jake Adams. Advanced Aquarist.
5. Water flow is more important for corals than light. Part II: The science of corals and water flow By Jake Adams. Advanced Aquarist.
6. Water Flow is More Important for Corals Than Light By Jake Adams. Advanced Aquarist.
7. Water Flow is More Important for Corals Than Light Part 4: Basics of Hydrodynamics By Jake Adams. Advanced Aquarist.
8. Water Flow is More Important for Corals Than Light, Part V By Jake Adams. Advanced Aquarist.
9. Grow with the Flow By Tim Wijgerde. Advanced Aquarist.
10. Underwater Light Field and its Comparison to Metal Halide Lighting By Sanjay Joshi. Advanced Aquarist.
11. Advanced Beginnings: The Basics Of Water Movement In The Reef Aquarium By J. Warrick. Advanced Aquarist.
12. Laminar Flow v.s. Turbulent Flow Engineering Concepts Blog.
13. Sizing a Biofilter BIOFILTRATION FOR AQUACULTURE.
14. D. J. Bottjer. (1980). Branching Morphology of the Reef Coral Acropora cervicornis in Different Hydraulic Regimes. Journal of Paleontology, 54(5), 1102–1107.
15. T. Bouderlique, J. Petersen, L. Faure, D. Abed-Navandi, A. Bouchnita, B. Mueller, M. Nazarov, L. Englmaier, Ma. Tesarova, P. R. Frade, T. Zikmund, T. Koehne, J. Kaiser, K. Fried, C. Wild, O. Pantos, A. Hellander, J. Bythell, I. Adameyko. (2022). Surface flow for colonial integration in reef-building corals. Current Biology, Volume 32, Issue 12, Pages 2596-2609.e7
16. N. Chindapol, J. A. Kaandorp, C. Cronemberger, T. Mass, A. Genin. (2013). Modelling Growth and Form of the Scleractinian Coral Pocillopora verrucosa and the Influence of Hydrodynamics. PLoS Computational Biology, January.
17. J. S. Christiansen, M. Jobling. (1990). The behaviour and the relationship between food intake and growth of juvenile Arctic charr, Salvelinus alpinus L., subjected to sustained exercise. Canadian Journal of Zoology.
18. C-F. Dai, M-C. Lin. (1993). The effects of flow on feeding of three gorgonians from southern Taiwan, Journal of Experimental Marine Biology and Ecology. Volume 173, Issue 1, Pages 57-69.
19. K. Davis, G. Pawlak, S. Monismith (2021). Turbulence and Coral Reefs. Annual Review of Marine Science. Vol. 13:343-373.
20. W. C. Dennison, D. J. Barnes. (1988). Effect of water motion on coral photosynthesis and calcification. Journal of Experimental Marine Biology and Ecology, Volume 115, Issue 1, Pages 67-77.
21. J. L. Johansen, O. Akanyeti, J. C. Liao. (2020). Oxygen consumption of drift-feeding rainbow trout: the energetic tradeoff between locomotion and feeding in flow. J Exp Biol 15 June 2020; 223 (12): jeb220962.
22. J. Kaandorp. (1999). Morphological analysis of growth forms of branching marine sessile organisms along environmental gradients. Marine Biology 134, 295–306.
23. M. Kremien, U. Shavit, T. Mass, A. Genin. (2013). Benefit of pulsation in soft corals. Proceedings of the National Academy of Sciences of the United States of America. 110(22)8978-8983.
24. M. Kiflawi, A. Genin. (1997). Prey Flux Manipulation and the Feeding Rates of Reef-Dwelling Planktivorous Fish. Ecology, 78(4), 1062–1077.
25. S. Lee, S. Davy, S-L. Tang. P. S. Kench. (2017). Water flow buffers shifts in bacterial community structure in heat-stressed Acropora muricata. Sci Rep 7, 43600.
26. H. S. Lenihan, J. L. Hench, S. J. Holbrook, R. J. Schmitt, M. Potoski. (2015). Hydrodynamics influence coral performance through simultaneous direct and indirect effects. Ecology, 96: 1540-1549.
27. O. Levy, L. Mizrahi, N. Chadwick. (2001). Factors Controlling the Expansion Behavior of Favia favus (Cnidaria: Scleractinia): Effects of Light, Flow, and Planktonic Prey. The Biological bulletin. 200. 118-26.
28. X. Li, L. Ji, L. Wu, X. Gao, X. Li, J. Li, Y. Liu. (2019). Effect of flow velocity on the growth, stress and immune responses of turbot (Scophthalmus maximus) in recirculating aquaculture systems. Fish & Shellfish Immunology, Volume 86, Pages 1169-1176.
29. R. J. Lowe, J. R. Koseff, S. G. Monismith, J. L. Falter. (2005). Oscillatory flow through submerged canopies: 2. Canopy mass transfer. J. Geophys. Res., 110, C10017.
30. C. A. Ludington. (1979). Tidal Modifications and Associated Circulation in a Platform Reef Lagoon. Marine and Freshwater Research 30, 425-430.
31. A. Lugo-Fernández, H. H. Roberts, W. J. Wiseman, Jr. Tide Effects on Wave Attenuation and Wave Set-up on a Caribbean Coral Reef, Estuarine. Coastal and Shelf Science, Volume 47, Issue 4, 1998, Pages 385-393.
32. T. Nakamura, H. Yamasaki. (2006). Morphological changes of pocilloporid corals exposed to water flow. Proc 10th Int Coral Reef Symp. 1. 872-875.
33. T. Nakamura, R. van Woesik.(2001). Water-flow rates and passive diffusion partially explain differential survival of corals during the 1998 bleaching event. MEPS 212:301-304.
34. T. Nakamura, R. van Woesik, H. Yamasaki. (2005). Photoinhibition of photosynthesis is reduced by water flow in the reef-building coral Acropora digitifera. MEPS 301:109-118.
35. G. Nishihara, J. Ackerman (2012). Mass transport in aquatic environments. Fluid Mechanics of Environmental Interfaces, Second Edition.
36. A. Nilsen, Ørjan Hagen, C. A. Johnsen, H. Prytz, Bingfei Zhou, K. Vale Nielsen, M. Bjørnevik. (2019). The importance of exercise: Increased water velocity improves growth of Atlantic salmon in closed cages. Aquaculture, Volume 501, Pages 537-546.
37. C. O. Pacherres, S. Ahmerkamp, K. Koren, C. Richter, M. Holtappels. (2022). Ciliary flows in corals ventilate target areas of high photosynthetic oxygen production. Curr Biol. 2022 Oct 10;32(19):4150-4158.e3.
38. M. R. Patterson, K. P. Sebens, R. R. Olson. (1991). In situ measurements of flow effects on primary production and dark respiration in reef corals. Limnology and Oceanography, 36
39. M. Reidenbach, J. Koseff, S. Monismith, J. Steinbuck, A. Genin (2006). The effects of wave and morphology on mass transfer within branched reef corals. Limnology and Oceanography - LIMNOL OCEANOGR. 51. 1134-1141.
40. O. H. Shapiro, V. I. Fernandez , M. Garren, J. S. Guasto, F. P. Debaillon-Vesque, E. Kramarsky-Winter, A. Vardi, R. Stocker. (2014). Vortical ciliary flows actively enhance mass transport in reef corals. Proc Natl Acad Sci U S A. 2014 Sep 16;111(37):13391-6.
41. M. Schutter, J. Crocker, A. Paijmans, M. Janse, R. Osinga, A. J. Verreth, R. H. Wijffels. (2010). The effect of different flow regimes on the growth and metabolic rates of the scleractinian coral Galaxea fascicularis. Coral Reefs 29, 737–748.
42. K. P. Sebens, B. Helmuth, E. Carrington, B. Agius. (2003). Effects of water flow on growth and energetics of the scleractinian coral Agaricia tenuifolia in Belize. Coral Reefs 22, 35–47.
43. C. D. Storlazzi, A. S. Ogston, M. H. Bothner, M. E. Field, M. K. Presto. (2004). Wave- and tidally-driven flow and sediment flux across a fringing coral reef: Southern Molokai, Hawaii, Continental Shelf Research, Volume 24, Issue 12, Pages 1397-1419.
44. F. Solstorm, D. Solstorm, F. Oppeda, A. Fernö, T. Fraser, R. Olsen. (2015). Fast water currents reduce production performance of post-smolt Atlantic salmon Salmo salar. Aquaculture Environment Interactions. 7. 125-134.
45. A. Taniguchi, S. Nishimura, M. Eguchi. (2024). Coral mucus effects on bacterial growth, respiration, and grazing mortality in reef systems. Journal of Experimental Marine Biology and Ecology, Volume 573,152003.
46. H. Wu , Y. Yamada , P-S. Chuang, K. Ishikawa, S. Mitarai. (2024). Effects of flows on transparent exopolymer particles released from branching Acropora coral colonies. Front. Mar. Sci. 11:1404526.
47. T. Wijgerde, P. Spijkers, E. Karruppannan, J. A. J. Verreth, R. Osinga. (2012). Water Flow Affects Zooplankton Feeding by the Scleractinian Coral Galaxea fascicularis on a Polyp and Colony Level, Journal of Marine Sciences, 2012, 854849, 7 pages.
48. J. Charles Delbeek, Julian Sprung. (2005). The Reef Aquarium: Science, Art, and Technology. Miami Gardens, FL: Ricordea Publishing.
49. Stephen Spotte. (1991). Captive Seawater Fishes: Science and Technology. Wiley-Interscience.
50. Svein A. Fosså, Alf Jacob Nilsen. (1996). The Modern Coral Reef Aquarium, Volume 1. Birgit Schmettkamp Verlag.
1. 浪 v.s. 流
浪(Wave)以及流(Current)這兩個詞在玩家間常會被混著使用,但在探討流體狀態時兩者其實是不太一樣的概念。
浪的常用英文「Wave」其實就是物理學中的波。波的本質其實是能量的傳遞,而所謂的浪通常是指水以週期性的運動來傳遞能量,而最直觀的例子便是你在海邊所看到那一波一波的海浪。在海洋中的浪多半是由風所提供能量,因此主要發生在表層,而隨著接觸到陸地,這些長波會被壓縮和攤平而讓水反覆的被來回移動。不過由於主要被傳遞的是能量而非分子本身所以單純的浪在長距離移動物質時的效率並不高。
流則是指水分子持續移動的狀態。相對於波,流對於長距離移動物質有更好的效率。在海洋中的水流可以到達很大的規模,甚至可以帶著許多的養分或生物等物質在大洋間移動,也就時我們常聽到的洋流或環流(Gyre)。除了大範圍的洋流外,海浪在接觸到障礙後所碎裂出的部分也提供了淺海區域一些局部的水流,而這些流同樣也提供了這些環境一定的物質交換。
2. 流量
流量指的是單位時間內所能移動的水之體積。流量的主要會被用在一些需要計算水體置換效率的用途,如過濾、溫控、或添加等。由於方便量化且多數市售造流設備也都有標示,流量往往是最常被玩家討論的一個參數,然而其意義也僅是能把多少水從吸水口丟到出水口而已,並不見得能完全代表一顆幫浦的輸出狀況。
3. 流速
如果要探討水流對生物及環境的直接影響,流速會是一個比較常用的參數。顧名思義,流速指的就是水流的速度,你可以想像為單位時間內一個小顆粒在水中被移動的距離。「移動」的概念也就意味著能確實的帶來及帶走物質,因此流速這個參數相對比較能體現生物實際面對的水流環境。實際在缸中影響流速的因子很多,因此多數市售造流設備並不會特別標示,而若要測量的話除了使用昂貴的流速儀外亦可透過簡單的錄影或計時觀察缸中的小顆粒(飼料或粉塵等)在特定時間內的移動距離來做粗略的估算。
4. 何謂亂流?
許多玩家間的討論都會提到海水缸需要所謂的「亂流」,但這到底是什麼意思呢? 在流體力學中,流體有兩大類型的流動狀態: Laminar Flow以及Turbulent Flow。Laminar Flow常被翻作層流,其定義為一平行移動不同層間不會互相混合的穩定流動狀態;而Turbulent Flow則常被翻譯作亂流、湍流、或紊流,而其定義也正好相反,指的是壓力、流速、流向等性質都混沌無法預測的流。

圖一、Laminar Flow v.s. Turbulent Flow (圖片來源: Laminar Flow v.s. Turbulent Flow)
不過既然亂流是無法預測的那究竟要如何以比較科學的方式去判別呢?1883年Osborne Reynolds在管子中進行了一系列流體實驗並根據結果整理出了一個公式來判斷觀察到的流究竟是層流還是亂流,而這個公式的計算結果便是著名的雷諾數(Reynolds number),而當雷諾數越高,流體的狀態就越亂。在圖二中的Re便是雷諾數,而ρ為流體密度、u為流速、L為特徵長度(就是系統的規模)、μ則為流體之黏滯性、 ν 為流體的運動黏滯性(密度與黏滯性比值)。
這乍看之下可能會讓人有點摸不著頭緒,但在我們的用途下其實幾乎可以簡化到剩流速和特徵長度這兩個因子,而藉此我們就能得到一個結論: 流速越快、流動範圍越大,流就越亂。

圖二、Reynolds number 公式 (圖片來源: Reynolds number)
5. 邊界層(Boundary layer)與物質交換
了解了一些水流的基本性質後,我們再來聊聊水接觸到其他物體後的現象。物體表面會和水產生摩擦力進而產生一層相對停滯的水,這也就是所謂的邊界層(Boundary layer)。常見的邊界層定義包含了Momentum Boundary Layer和Concentration Boundary Layer兩種。前者指的是物體表面因摩擦力而造成流速衰減的水層,後者則是以水中物質的濃度變化作定義,而從這兩種定義我們可以知道邊界層會造成流速的下降以及物質混合的效率下降。
邊界層的厚度則很大程度是取決於雷諾數,也就是水流有多亂,而若雷諾數越高則邊界層的厚度也會隨之下降[35],這也是亂流的一大重要性。

圖三、 Momentum Boundary Layer和Concentration Boundary Layer (圖片來源: Mass transport in aquatic environments)
二 、水流對飼養生物的影響
1. 自然環境中的水流
不像某些淡水棲地可能水體幾乎是靜止的,絕大多數的海洋環境都有一定程度的水流,而生存在不同區域的生物則會對水流有不同的偏好與適應能力。
圖四中可以看到一個典型的珊瑚礁在不同區域的流(Uc)與浪(Uw)之比例。首先從鄰靠外海的Forereef開始,這裡主要會是由表層的洋流或是深海的湧升流所帶動的持續性水流;到了水深較淺的Reef crest時,強勁的浪開始主導使得這邊成為防波堤一般的區域;更後方的Reef flat由於許多的浪已被抵銷掉使的流與浪的比例趨近相同;而在能量被一路消耗後最後的Lagoon區則又會隨著水深增加而轉為以流為主的緩和環境。
而除了洋流與風力外,潮汐亦會對這些環境的水流產生影響。每天漲潮和退潮的週期會造成持續數小時的大規模反向水流並使水位發生變化,而這也使珊瑚礁環境在漲潮與退潮時不同的水流狀態。在漲潮時由於水位上升,外海的物質與能量會更容易被帶到珊瑚礁內部; 而在退潮時的低水位則會讓外海的浪與流更容易被抵銷掉使得水流變得相對緩和,甚至在一些潮池內可能完全靜止[30, 31, 43]。

圖四、不同珊瑚礁區域的流與浪 (圖片來源: Turbulence and Coral Reefs)
2. 魚類
由於海洋環境中的水很少會是絕對靜止的,絕大多數的海水魚都還是比較適應有一定水流的環境。適當的水流能增加魚類的運動進而使肌肉量上升、減少體脂[44]、並使成長率與代謝速率提升[36]。不過長時間過強的水流亦有可能增加魚類的緊迫,尤其是一些游泳能力較差的底棲魚[28]。
水流亦對許多魚類的攝食行為有一定的影響,例如一些以浮游生物為食的魚在適當的流速下反而可能有更高的攝食率[24]並節省自身所花的能量[21],但一些以珊瑚或藻類為食的定點攝食魚類則可能因太強的流而影響攝食行為,如Lenihan等人便觀察到在水流變化率大的珊瑚礁區域中以珊瑚為食的魚對珊瑚的下口率有顯著下降[26] 。此外魚類之間的領域性與打鬥行為在弱流下也可能更明顯,而反之在強流下一些魚類亦可能表現出更多的群遊行為[17]。
3. 珊瑚
(1) 物質交換
珊瑚的生理構造相當簡單,並不像魚類等構造較複雜的動物一樣有鰓這樣的特化的高表面積氣體交換器官或是心血管這樣的循環系統,因此環境中的的水流會直接影響到他們交換氧氣或二氧化碳等物質的效率。
如同在運動後耗氧量增加我們會透過喘氣來獲得更多氧,充足的水流同樣也可以藉由降低邊界層厚度提升珊瑚的呼吸作用效率。部分的珊瑚如一些Xeniidae(八爪)的成員可以藉由觸手的規律收縮來主動製造水流來維持基本的生理機能[23],這幾年的研究亦有發現石珊瑚的表面其實有許多微小的纖毛可以透過不斷旋轉製造垂直的水流以降低邊界層厚度(圖五)[37, 40],然而這些手段的效率多半還是比主動呼吸差了點,因此許多研究結果仍然顯示水流與呼吸作用有很大的相關性[4, 5, 6, 38, 42]。
珊瑚的光合作用效率亦受到水流很大的影響。共生藻在行光合作用的同時也會產生許多ROS(Reactive Oxygen Species),而這些ROS對生物的組織會造成很大的傷害,同時也是造成珊瑚白化的一大原因,這也是為何絕大多數光合作用生物都會有Photoinhibition的現象,也就是當到了一定的光強度時光合作用效率反而會下降。充足的水流便可藉由增加這些ROS的來除效率來減緩Photoinhibition進而使珊瑚可以在更強的光下繼續行光合作用,而從圖七也可以看到在較高的流速下光合作用的效率也可以達到更高的數值[6]。此外許多野外的研究亦發現在水流較強的區域珊瑚也更不容易白化,其中一部分的原因正是來自這個移除ROS的效果[6, 20, 33, 34]。

圖五、石珊瑚體表的纖毛 (圖片來源: Vortical ciliary flows actively enhance mass transport in reef corals)

圖六、水流流速與圖釘珊瑚(Pocillopora damicornis)之呼吸作用效率成正相關 (圖片來源: Water Flow is More Important for Corals Than Light)

圖七、不同水流流速與圖釘珊瑚(Pocillopora damicornis)之光合作用效率曲線 (圖片來源: Water Flow is More Important for Corals Than Light)
(2) 攝食與廢物移除
絕大多數的珊瑚成體為固著生長的動物,因此水流同樣也扮演著帶來食物以及帶走排遺和分泌物的角色。不同種類的珊瑚有不同的偏好攝食流速,戴昌鳳博士與林明炤博士的研究發現水螅體較大的海樹在弱一點的水流環境(7~9cm/s)有比較好的攝食效率,而水螅體小的海樹種類則在強流(40cm/s)下仍可正常伸展攝食[18];Levy等人發現他們所研究的龜殼腦在15cm/s的水流條件下觸手伸展的最多,而完全無水流的環境則不會伸展[27]; Wijgerde等人亦發現Galaxea fascicularis 在5~15cm/s有最好的捕食效率(圖八)[47]。
此外,珊瑚所分泌的大量黏液等代謝物以及沉積在身上的粉塵汙泥亦需透過水流來移除以維持健康。珊瑚的黏液具有運輸物質以及調控表層微生物相等作用[15, 45],但這些黏液分泌也會受到包含水流在內的環境因子調控[15, 25],而很多珊瑚(尤其是軟珊瑚)也會週期性的製造一層厚厚的黏液來移除表層的藻類與雜質[9, 48]。Lee等人的研究便發現軸孔珊瑚的黏液微生物相是會受到水流影響的,他們的結果顯示在弱流高溫下珊瑚身上的病原菌會增加,但是在強水流下的珊瑚微生物相卻維持得很穩定[25];而Wu等人亦發現在強水流環境下珊瑚的黏液分泌量與環境中的細菌量都有下降都趨勢[46]。

圖八、Galaxea fascicularis 的單一水螅體(深色)及colony(淺色)在不同流速下捕食無節幼蟲的效率 (圖片來源: Water Flow Affects Zooplankton Feeding by the Scleractinian Coral Galaxea fascicularis on a Polyp and Colony Level)
(3) 生長
珊瑚的生長速率與生長型態同樣受到水流的調控。Dennison和Barnes等人的研究發現實驗室中的軸孔珊瑚在水流不足的情況下暗鈣化速率可以減少近60%而光鈣化速率則可以減少到25%[20],而諸多水缸養殖以及野外研究也都顯示許多珊瑚的生長速率和水流是有正相關的[5, 26, 32, 41]。其中Schutter等人的研究發現在水缸養殖中的Galaxea fascicularis雖然隨著水流增加成長速率也加快,但其光合作用和呼吸作用效率卻沒有顯著提升,而他們也認為這個生長速率提升的效果可能是來自於水流減少了藻類等其他競爭者或是病原的生長進而幫助了珊瑚[41]。
除了生長速率外,水流亦會影響珊瑚的生長型態。Chindapol等人發現Pocillopora verrucosa會在面向水流的方向會有更多的生長(圖九)[16],然而Bottjier對Acropora cervicornis的野外觀察反倒觀察到了在強水流下遠離水流生長的趨勢[14],因此雖然我們知道生長方向確實會受水流改變但實際會朝著哪邊則還是可能因珊瑚種類或水流強弱而影響。珊瑚的分枝多寡與粗細亦會受到水流強弱所影響,Kaandorp的研究與Nakamura和Yamasaki的研究發現Stylophora pistillata, Pocillopora damicornis, Seriatopora hysterix, Millepora alcicornis這幾種分枝狀珊瑚都會在強流下表現出更粗且更密的分枝[22, 32]。
圖九、Pocillopora verrucosa在無流(A)、弱流(BC)、與強流(DEF)下面向水流的生長狀態 (圖片來源: Modelling Growth and Form of the Scleractinian Coral Pocillopora verrucosa and the Influence of Hydrodynamics)
4. 養殖系統
(1) 水面擾動
多數封閉養殖系統都會需要某種形式的氣體交換來平衡由呼吸作用所消耗的氧氣及產生的碳酸,而水面擾動便是最常見的一個手段。就如同我們的血液會被輸入到肺中與吸入新鮮空氣接觸,養殖系統也可以藉由空氣與水的交界面來使氣體得以因為分壓差擴散,而水流便可以擾動水面增加這交界面的表面積讓擴散效率更好。此外,這一氣水界面同樣有邊界層的存在,因此良好的水流亦可藉由增加亂度(雷諾數)使變界層厚度降低增進擴散效率。
(2) 過濾與廢物排除
水流亦扮演著將廢物帶入過濾系統中的角色。一般常見的過濾器或是反應器都會利用幫浦將水打入內部處理後再回到缸中,而根據不同的需求該水流的流速可以被調整來達到最佳的接觸時間。
而在缸內營造良好的水流也同樣也是相當重要,除了讓溶解的物質濘更快的被運輸擴散外也能使糞便或殘餌等沉澱的顆粒狀廢物懸浮在水體中增加進入過濾系統的機率避免堆積在缸內的死角。
還有一點也很常被忽略,那就是我們缸內的沙石或玻璃等表面其實也都可以藉由表層或孔隙內部的生物相來行生物過濾。就好比你整個缸就是一個過濾器,甚至還可以看到一些缸子是完全沒有獨立過濾器的,因此缸內的循環造流與過濾用的循環有時也不見得是如此一刀兩斷的。
(3) 溫度平衡
無論是降溫還是加溫設備,沒有足夠的水流循環的話效率都會變得非常差。除了會嚴重的溫差外,若缸子較大亦有可能讓溫控幾乎失效甚至產生局部的熱點或冷點造成設備或缸子損壞。獨立的溫控設備通常會有廠商標示的建議流量,而若是直接置入缸內的類型如加溫棒或是分離式冷水機則需注意熱交換器周遭是否有足夠的水流持續循環。
另外水面擾動所增加的表面積亦可讓蒸發散熱的效率上升,因此若有溫度偏高的問題亦可將這點納入考量,只是若使用的為沉水式的馬達的話亦有可能反過來讓溫度上升。
三 、如何設置缸中的水流
1. 白努利定律(Bernoulli's Law)與流速
在開始談論水流的配置前我 先再補充一個流體力學的概念,也就是白努利定律。白努利定律的公式可簡化為三個部分,分別是動能/動態壓力( 1/2ρv^2 )、位能(ρgz)、靜態壓力(p),而三者的總和恆為一常數。乍聽之下也許有點難懂,但白努利定律的本質其實也就是能量守恆。舉例來說若一根水管的管徑縮小了但流量仍不變那流速自然就會增加,而既然能量往動能的部分跑了那貢獻到壓力部分的也就會變少進而使水壓下降。飛機的機翼、螺旋槳、魚類的鰭等其實都是運用這個原理以略為上傾的角度造成流速上升產生壓力差以獲得升力,而蛋白機的進氣文氏管同樣也是靠增加流速來減壓吸氣(這邊指的壓力都是指靜態壓力,而高壓水槍或是加壓水龍頭這類敘述中所提的則是動態壓力也就是這裡講的動能)。
若要將以上的觀念運用到水流配置中我們可以得到幾個重點: (1) 出水管徑變小會使流速加快 (2) 速度快的流可以藉由壓力差帶動周圍的流

白努利定律公式 (圖片來源: Bernoulli's principle)
2. 硬體設備
這邊我會著重在不同造流手段的介紹,若想瞭解不同馬達與幫浦的運作原理可以參考這篇: 水族常用的馬達種類
(1) 氣動式造流
氣動式造流的原理為利用往水中打氣製造的氣泡上浮時產生的壓力差帶動水流,是最早被用在水族飼養的造流手段。其優點在於能以低廉的成本移動大量的水體、能以單一設備同時驅動複數缸子、沒有會傷到飼養生物的葉片、且不會影響水溫,但缺點則包含了噪音以及氣泡導致的噴濺在海水中容易產生鹽漬。
現今氣動式造流在海水飼養中主要被運用在一些生物幼體的飼育以避免旋轉的葉片可能造成的損傷,此外其附帶大量氣水攪拌的功能亦會被運用在UAS藻屏(Upflow Algae Scrubber)或蛋白機等用途上。

圖十、直接在缸中打氣所產生的氣動環流 (圖片來源: Captive Seawater Fishes: Science and Technology)

圖十一、亦可利用不同的設計來改變水流推動效率和流向,如這裡便是在入水處鑽洞使進氣得以更平均 (圖片來源: Captive Seawater Fishes: Science and Technology)
(2) 葉輪式幫浦
葉輪式幫浦的入水與出水都可接上各種管件以調整水流的方向,因此常被用來作為過濾器等設備的動力源。不過葉輪式幫浦在推動大範圍水流的效率並不如之後會提到的螺旋槳式幫浦或是恆流式幫浦,但能獨立配管這點仍有很大的優勢。
在選購時須注意不同馬達的設計,例如是設計來沉水使用、離水使用、還是皆可? 是否有流量調整功能? 能否承受持續的開關? 又或是若你想垂直上推水流的話揚程是否足夠?

圖十二、葉輪式幫浦運用在缸子的過濾主循環(Return Pump)以及缸內造流循環(Closed Loop) (圖片來源: What is a Closed-Loop Aqaurium?)
(3) 螺旋槳式幫浦 & 恆流式幫浦
我們一般俗稱「造流馬達」或是「造浪馬達」通常就是指這兩類幫浦。螺炫獎式與橫流式幫浦移動大範圍的水流的效率相當好,而且這幾年也有了很多可以調節流量、設置不同模式、甚至定時功能的變頻產品(aka DC馬達),因此現今也成為海水缸中最常見的主缸造流選擇。
在選擇這些造流馬達時除了考慮流量與可控性外更重要的是其輸出的水流性質,而這點通常是由出水口與葉片的設計來決定。通常出水口及葉片的截面積越大則水流會越偏向廣範圍的圓錐形緩流;反之若你希望獲得比較高的流速或是想把水推得更遠就得找輸出端截面積小一點的或是在出水有一些集流設計的馬達。
圖十三、Tunze的Turbelle Stream為最早的螺獎式幫浦商品 (圖片來源: Das Tunze Turbelle® Stream Kit TS24)

圖十四、 Ecotech的Vortech將Motor移至缸外的設計減少了缸內所佔的體積與熱源,但犧牲了水流方向的調整能力 (圖片來源: Aquarium and Pond Pumps)

圖十五、橫流式幫浦的出水型態多半也屬於集中的高流速水流 (圖片來源: Gyre XF350 Cloud Edition - Pump Only (5280 GPH))
(4) Surge Device
這類型的水流裝置是利用用其他的幫浦作為動力源來將水推入一個暫時的儲水空間內,然後在水囤積到一定容量後在一次湧出提供缸內一波一波的水流,而其Surge的名字便是由此而來(如同海洋中的湧浪)。
Surge Device可以擴增原有幫浦一次帶動的水流並營造出來回的浪,不過缺點則是很佔空間且多半受限於容器大小而難以提供持續性的水流,因此主要被用在較大型的缸子內製造大規模的水體湧動或震盪。

圖十六、Wavebox是利用螺旋槳幫浦驅動的Surge device (圖片來源: Meine Erfahrungen mit der Tunze Wavebox 6208)

圖十七、"Dump bucket" surge device (圖片來源: The Reef Aquarium: Science, Art, and Technology)

圖十八、 由海洋生物學家Bruce Carlson所設計,以虹吸原理來水的Carlson Surge Device (圖片來源: Farm-Raised Corals and Marine Fish: Let's Tour the ORA® Aquaculture Facility)
(5) Switching Current Water Director (SCWD)
SCWD是利用機械式原理將單一的入水以隨機的方式分配到兩個以上的出水中以營造出持續變化的流向,而隨著流速越快,切換頻率也會越高。這個裝置的優點在於完全不需要電子元件便能讓單一一顆馬達輸出有變化的水流,但由於海水飼養中往往容易有各種鈣化或生物生長到機械式構造上使裝置失效,再加上現今已有各種方便的可控造流馬達,因此這幾年已經很少有玩家會使用了。

圖十九、Switching Current Water Director (圖片來源: The Reef Aquarium: Science, Art, and Technology)
(6) 水舞機
水舞機同樣也是用來切換水流流向的設備,不過與SCWD的差異在於水舞機是用馬達來規律的旋轉出水,因此會需要外接電源。水舞機大致分為兩類: 一種是可以接上獨立的馬達(通常就是一般螺旋槳式造流)並讓其擺動(圖二十); 另一種則是要外接配管來導入水流,並用馬達來擺動該出水端(圖二十一)。

圖二十、接上造流馬達的水舞機 (圖片來源: Sea Sweep from Sea Swirl is a new propeller pump rotating device)

圖二十一、外接配管的水舞機 (圖片來源: The Sea Sweep and Multi-Size Sea Swirl Review)
(6) 造流接頭
造流接頭為一系列利用基本的物理原理改變馬達出水的流速或流向的裝置統稱,通常會裝在主循環或Closed Loop的葉輪幫浦出水口來使用,而這邊我會簡單介紹一下幾種比較常見的類型。
首先是水流加速器(圖二十二&二十三),這類型的接頭是透過將出水的管徑縮小來提升流速(也就是白努利定律),不過回壓則有可能導致原來的流量略微下降; 而第二類則是旋轉接頭(圖二十四),這類型的接頭主要是利用機械式元件來讓出水的方向持續旋轉,但和前面提到的SCWD一樣有容易卡住的缺點; 最後則是隨機式的出水接頭(圖二十五),這種接頭就不是靠機械式原件來改變流向而是以導流設計來使出水的方向隨機變化,因此就比較不會有卡住的缺點,只是由於變化頻率快所以能帶動的水體範圍還是有限,故只有在小缸中才比較能看出效果(這點旋轉式接頭也一樣)。

圖二十二、最簡單的鴨嘴式水流加速器 (圖片來源: Water Output Nozzle Duckbill)

圖二十三、Eductor型的加速器除了單純透過縮小管竟加速水流外還額外設計了入水端讓周圍的水也可以因為壓力差被吸入,因此反而能提升缸內的循環流量數倍 (圖片來源: Sizing eductor nozzles)

圖二十四、Hydor的旋轉式接頭 (圖片來源: FLO)
圖二十五、 VCA的Random Flow Generator (圖片來源: The New Flex Series Is Here! Check out the Extremely Durable and Flexible Random Flow Generator®)
3. 設置概念
(1) 主循環/過濾循環
循環量
在很多早期的討輪中可能會看到不少建議都是倡導每小時要循環主缸的水量十幾次甚至二十次的流量,但在絕大多數的缸子中這都已經遠遠超過實際所需了。
當然啦,你實際會需要的過濾流量也會取決飼養密度與生物種類、餵食量、使用的設備與濾材、以及過濾的核心究竟是在哪裡,但即使是水產養殖等級的密度與餵食量加上又把絕大多數的過濾都放在主循環中的這種極端情況下,每小時十倍循環也已經是非常高的數值了[11, 13, 49],更不用講一般的居家海水混養缸。
另外一個導致很多玩家把主循環搞到這種程度的原因是他們將主循環與主缸內部的造流給綁在一起了。這個狀況在早期也許還說得通,因為當時也還沒有這麼多造流選擇,所以玩家缸子內唯一的馬達可能就只有主循環。只是現今已有非常多高效率的造流馬達可供選擇了,而相比之下主循環的造流效率可以說是其差無比。因此除了一些缸內水流需求不高的小缸外我是不建議將主循環納入主缸的造流內。
講了那麼多,那究竟你的缸子需要多少的主循環流量呢? 若你的飼養目標是以柏林系統為基礎、生物過濾主要仰賴主缸中的沙石的混養缸的話,那每小時4~6倍的主循環量已經非常足夠了(我的很多缸子甚至只有2~3倍而已); 而若是高密度飼養的FO缸且主要的生物濾材是放置在底缸等過濾區的話,那我會把循環量調整到10~12倍。
至於除此之外的設置就自己抓個中間值囉,但在實際選用循環馬達前也要記得將配管與垂直上推的壓損考慮進來。市面上的馬達通常會標示揚程,也就是馬達上推多少高度時會損失多少流量,只是實務上又還有配管這個因子在,因此實在很難準確預估。不過就像我前面所提的,絕大多數人其實不太需要擔心主循環不足的問題,因此通常也只需抓個大略的保險值就好。若要確認的話也可以用一個已知容量的容器(e.g. 桶子或袋子)來盛接循環的出水或入水看多久會裝滿,然後再稍微估算一下即可。
水怎麼流?
除了單純的循環量以外,另一個重點是要如何讓水流過你的過濾設備。
第一個容易被忽略的點是水面的油膜,這些漂浮的雜質除了不美觀外亦會直接影響光照的穿透與氣體交換,此外油膜也會持續吸附更多的水中雜質使其浮在水面上難以被過濾清除,因此維持水面的清潔對於飼養而言是有很多幫助的,我甚至認為能夠有效濾移除表層水的重要性遠高於在溢流隔板上開一堆洞來吸大便(水面一樣能成為水流死角!)。主缸的油膜通常由上溢流或是將過濾器進水孔接上可吸入表層水的處理器來去除,不過這點在很多傳統的缸子設計中很常被輕視,因此在購買現成缸或是訂製新缸時最好是先注意一下。
第二類型的油膜則容易囤積在底濾或側背濾缸的隔間中。這些油膜雖然比較不會礙眼但仍會造成影響氣體交換,此外也代表著你缸內其實還有一堆東西是進不了過濾內只能浮在那裏腐爛。改善方法也與主缸中的油膜相似,只是底缸區域通常比較不會有水面擾動,因此更需要營造出水位落差讓雜質們可以順著瀑布被沖入水體內,而這個自由落體的效果除了去油膜外亦可以提供一些額外的擾動增加氣體交換。
再來則是流經濾材的水流。在玩家間可能常會聽到如「強迫式過濾」或「乾溼分離」之類的用語,而這些概念不外乎就是希望濾材可以發揮最好的效果。強迫式過濾指的是將水流強制導經濾材的手法(圖二十六),雖然聽起來很炫泡但實際操作上其實也只是不要讓水往其他孔隙跑或溢出去而已,而過濾區域的截面積越小強迫的效果也會越好,因為流速會提升且水也比較沒那麼多亂跑或停滯的空間; 而乾溼分離則也算是強迫式過濾的一類,只是其利用的是重力來使水自然鄰到濾材上因此通常會用在離水使用的濾材如白棉或是滴流球(圖二十七)。
不過和循環量一樣,絕大多數人根本也不會需要那麼強的過濾效能,甚至有些人還會為了維持一點缸內養分而降低過濾效能,因此我會建議與其拘泥於各種曲折迂迴的底缸分隔設計還不如就專注在維持水流暢通減少堆積沉積物的死角即可。不過也有少部分吸附劑或向NP豆豆這種有特殊水流需求的濾材就得要多注意一下了,但若只是一般的生物濾材的話基本上不要有太誇張的厚重汙泥或生物膜堆積就不太需要擔心了。

圖二十六、常見的浸水強迫式過濾設計(圖片來源: The Modern Coral Reef Aquarium, Volume 1)

圖二十七、乾溼分離的滴流式過濾 (圖片來源: The Modern Coral Reef Aquarium, Volume 1.)
(2) 主缸造流
流速
雖然很多玩家還是會使用流量來討論主缸的造流,不過其實流速才是真正會影響到生物的參數,因此我通常會建議以此作為判斷基準。由於習性以及生長環境的差異,不同生物自然會有不同的適應流速。以魚類等有移動能力的動物來說通常越是底棲的物種對強水流的適應能力越差,反之主要活動於開放水域的種類則會偏好更快的流速。
而珊瑚的話就有比較多因子要考量了。對於有共生藻的珊瑚來說,水流很重要的一項功能便是帶走光合作用產生的氧化廢物,因此水流的強若會直接關係到珊瑚對光照甚至是溫度的承受能力。長話短說,如果你的光照越強,水流也要越強。若要比較粗略的參考值的話大約100 µmols/m/s 的中弱光照可以搭配5~10 cm/s的流速; 而400 µmols/m/s以上的強光則至少需要15~20 cm/s的流速搭配(圖二十八)[6]。
不過這些數值當然也只是給你做個初始的參考,實際飼養時還是得依生物狀況為主。而除了光照外,珊瑚本身的型態也會很大程度的影響其水流適性,例如一些組織肥厚的肉多LPS或是八爪椰花這類軟珊瑚可能就無法承受太強勁的流,反之水螅體較小的軸孔珊瑚科(Acroporidae)或鹿角珊瑚科(Pocilloporidae)SPS以及皮革系列的軟珊瑚(Sarcophytidae)則會偏好強一點的流。從雷諾數的公式中我們可以知道當受流截面積越大則水流也會越容易亂,因此大體上來說水螅體大的珊瑚確實也比較不需要那麼強的流。

圖二十八、水流與光照的搭配建議值 (圖片來源: Water Flow is More Important for Corals Than Light)
水流環境的營造
不同的玩家也都有不同的造流偏好以及習慣,因此如何設置缸內水流其實也沒有個標準答案。這裡我會提供一些基本概念與可以嘗試的初始設置,不過實務上還是得依你的生物狀況來調整就是了。
- 環流
營造環流效率最好的方式便是將你的馬達或出水口擺放在接近水面處,因為要擾動表層水的難度遠低於在底部擾動(你可以試試在水面與水底攪動一桶水的阻力就知道了),所以可以更容易的產生高流速並利用白努利定律帶動其他水。第二個重點則是沿著缸子的長邊吹,因為這樣只要能把水推到對面去自然就會有股趨勢將對面那端的水帶回來(沿短邊吹的話帶動的範圍會比較小),而只要馬達像這樣持續運轉一段時間就會讓動能堆積起來並以相當節能的方式帶動整缸水動起來。
不過這樣單方向水流長期飼養下還是容易使沉積物堆及在同樣的區域以及讓珊瑚的成長變得不對稱,因此下一個重點便是改變流向。以環流來說這點其實相當容易,只需在缸子另一端在擺一顆馬達並設置為以至少五到十分鐘以上(越大的缸需要越久)的間隔交換開就可以讓流向有交替變化了。


圖二十九 & 三十、由水體表面往下循環的環流缸正視圖,可透過A與B馬達的交替來切換整缸的流向

圖三十一、三面觀賞的屏風缸亦可將環流的方向改圍繞著缸子做順時鐘以及逆時鐘循環,如上面的俯視圖
- 湧浪
早期營造湧浪會需要使用Surge device,不過目前已可透過調整馬達開關頻率與整缸水體共鳴來帶動了。這類型水流模式雖然在很多現今的可控馬達中都會看到,但其實用度其實並沒有那麼高,主要運用在輔助的造流或是以編程功能安排在一天中的特定時間執行。
- 對吹
透過移動對沖點來造流雖然效率不如環流,但調整的彈性就高了很多,因此也就可以更精巧的把流送到目標處。這個方法適合用在小缸、鋪細沙的缸、希望營造不同棲地的混養缸、或是養一些不喜歡持續被單向水流吹的生物,而除此之外亦可利用馬達的定時編程功能與其他水流模式搭配來針對性的改善死角而不用整天都跑同一種模式。

圖三十二、A與B馬達的對沖點可以透過改變兩者的相對流量來調整,例如當A的輸出由80%逐漸下調至10%時,B就可以反過來從10%逐漸上調至80%
- 配置參考

圖三十三、這缸的尺寸為60x45x45cm,配置兩顆Tunze 6055調製30%輸出並間格約五分鐘交替開啟。由於油膜處理器在缸子後方,兩顆馬達都是稍為往斜前對角的方向吹以將油膜帶到後面,不過可以看到前端的底砂就因為持續的環流而難以維持整齊。

圖三十四、這缸的尺寸為120x60x60cm,使用兩顆Maxspect Gyre XF350以上限50%輸出的方式不斷變化流量。這缸主要是軟珊瑚,因此若長時間以單向水流吹的話很容易變得東倒西歪,所以才改成用持續變換對沖點的方式提供珊瑚所需的水流。


圖三十五 & 三十六、這缸尺寸為60x45x45cm,使用一顆捷寶MLW-10在後側底部吹。原先這缸其時僅有主循環的出水配上鴨嘴對水面吹而已,雖然對這些珊瑚種類來說是夠了但仍有很多區域會堆積粉塵,因此後來配了一顆MLW-10將後側的沉澱物吹到前面並以編程功能在不同時段跑不同模式。
四 、參考資料
1. Reynolds number Wikipedia.
2. Turbulence Wikipedia.
3. Bernoulli's principle Wikipedia.
4. Water flow is more important for corals than light. Part 1. Introduction to Gas Exchange By Jake Adams. Advanced Aquarist.
5. Water flow is more important for corals than light. Part II: The science of corals and water flow By Jake Adams. Advanced Aquarist.
6. Water Flow is More Important for Corals Than Light By Jake Adams. Advanced Aquarist.
7. Water Flow is More Important for Corals Than Light Part 4: Basics of Hydrodynamics By Jake Adams. Advanced Aquarist.
8. Water Flow is More Important for Corals Than Light, Part V By Jake Adams. Advanced Aquarist.
9. Grow with the Flow By Tim Wijgerde. Advanced Aquarist.
10. Underwater Light Field and its Comparison to Metal Halide Lighting By Sanjay Joshi. Advanced Aquarist.
11. Advanced Beginnings: The Basics Of Water Movement In The Reef Aquarium By J. Warrick. Advanced Aquarist.
12. Laminar Flow v.s. Turbulent Flow Engineering Concepts Blog.
13. Sizing a Biofilter BIOFILTRATION FOR AQUACULTURE.
14. D. J. Bottjer. (1980). Branching Morphology of the Reef Coral Acropora cervicornis in Different Hydraulic Regimes. Journal of Paleontology, 54(5), 1102–1107.
15. T. Bouderlique, J. Petersen, L. Faure, D. Abed-Navandi, A. Bouchnita, B. Mueller, M. Nazarov, L. Englmaier, Ma. Tesarova, P. R. Frade, T. Zikmund, T. Koehne, J. Kaiser, K. Fried, C. Wild, O. Pantos, A. Hellander, J. Bythell, I. Adameyko. (2022). Surface flow for colonial integration in reef-building corals. Current Biology, Volume 32, Issue 12, Pages 2596-2609.e7
16. N. Chindapol, J. A. Kaandorp, C. Cronemberger, T. Mass, A. Genin. (2013). Modelling Growth and Form of the Scleractinian Coral Pocillopora verrucosa and the Influence of Hydrodynamics. PLoS Computational Biology, January.
17. J. S. Christiansen, M. Jobling. (1990). The behaviour and the relationship between food intake and growth of juvenile Arctic charr, Salvelinus alpinus L., subjected to sustained exercise. Canadian Journal of Zoology.
18. C-F. Dai, M-C. Lin. (1993). The effects of flow on feeding of three gorgonians from southern Taiwan, Journal of Experimental Marine Biology and Ecology. Volume 173, Issue 1, Pages 57-69.
19. K. Davis, G. Pawlak, S. Monismith (2021). Turbulence and Coral Reefs. Annual Review of Marine Science. Vol. 13:343-373.
20. W. C. Dennison, D. J. Barnes. (1988). Effect of water motion on coral photosynthesis and calcification. Journal of Experimental Marine Biology and Ecology, Volume 115, Issue 1, Pages 67-77.
21. J. L. Johansen, O. Akanyeti, J. C. Liao. (2020). Oxygen consumption of drift-feeding rainbow trout: the energetic tradeoff between locomotion and feeding in flow. J Exp Biol 15 June 2020; 223 (12): jeb220962.
22. J. Kaandorp. (1999). Morphological analysis of growth forms of branching marine sessile organisms along environmental gradients. Marine Biology 134, 295–306.
23. M. Kremien, U. Shavit, T. Mass, A. Genin. (2013). Benefit of pulsation in soft corals. Proceedings of the National Academy of Sciences of the United States of America. 110(22)8978-8983.
24. M. Kiflawi, A. Genin. (1997). Prey Flux Manipulation and the Feeding Rates of Reef-Dwelling Planktivorous Fish. Ecology, 78(4), 1062–1077.
25. S. Lee, S. Davy, S-L. Tang. P. S. Kench. (2017). Water flow buffers shifts in bacterial community structure in heat-stressed Acropora muricata. Sci Rep 7, 43600.
26. H. S. Lenihan, J. L. Hench, S. J. Holbrook, R. J. Schmitt, M. Potoski. (2015). Hydrodynamics influence coral performance through simultaneous direct and indirect effects. Ecology, 96: 1540-1549.
27. O. Levy, L. Mizrahi, N. Chadwick. (2001). Factors Controlling the Expansion Behavior of Favia favus (Cnidaria: Scleractinia): Effects of Light, Flow, and Planktonic Prey. The Biological bulletin. 200. 118-26.
28. X. Li, L. Ji, L. Wu, X. Gao, X. Li, J. Li, Y. Liu. (2019). Effect of flow velocity on the growth, stress and immune responses of turbot (Scophthalmus maximus) in recirculating aquaculture systems. Fish & Shellfish Immunology, Volume 86, Pages 1169-1176.
29. R. J. Lowe, J. R. Koseff, S. G. Monismith, J. L. Falter. (2005). Oscillatory flow through submerged canopies: 2. Canopy mass transfer. J. Geophys. Res., 110, C10017.
30. C. A. Ludington. (1979). Tidal Modifications and Associated Circulation in a Platform Reef Lagoon. Marine and Freshwater Research 30, 425-430.
31. A. Lugo-Fernández, H. H. Roberts, W. J. Wiseman, Jr. Tide Effects on Wave Attenuation and Wave Set-up on a Caribbean Coral Reef, Estuarine. Coastal and Shelf Science, Volume 47, Issue 4, 1998, Pages 385-393.
32. T. Nakamura, H. Yamasaki. (2006). Morphological changes of pocilloporid corals exposed to water flow. Proc 10th Int Coral Reef Symp. 1. 872-875.
33. T. Nakamura, R. van Woesik.(2001). Water-flow rates and passive diffusion partially explain differential survival of corals during the 1998 bleaching event. MEPS 212:301-304.
34. T. Nakamura, R. van Woesik, H. Yamasaki. (2005). Photoinhibition of photosynthesis is reduced by water flow in the reef-building coral Acropora digitifera. MEPS 301:109-118.
35. G. Nishihara, J. Ackerman (2012). Mass transport in aquatic environments. Fluid Mechanics of Environmental Interfaces, Second Edition.
36. A. Nilsen, Ørjan Hagen, C. A. Johnsen, H. Prytz, Bingfei Zhou, K. Vale Nielsen, M. Bjørnevik. (2019). The importance of exercise: Increased water velocity improves growth of Atlantic salmon in closed cages. Aquaculture, Volume 501, Pages 537-546.
37. C. O. Pacherres, S. Ahmerkamp, K. Koren, C. Richter, M. Holtappels. (2022). Ciliary flows in corals ventilate target areas of high photosynthetic oxygen production. Curr Biol. 2022 Oct 10;32(19):4150-4158.e3.
38. M. R. Patterson, K. P. Sebens, R. R. Olson. (1991). In situ measurements of flow effects on primary production and dark respiration in reef corals. Limnology and Oceanography, 36
39. M. Reidenbach, J. Koseff, S. Monismith, J. Steinbuck, A. Genin (2006). The effects of wave and morphology on mass transfer within branched reef corals. Limnology and Oceanography - LIMNOL OCEANOGR. 51. 1134-1141.
40. O. H. Shapiro, V. I. Fernandez , M. Garren, J. S. Guasto, F. P. Debaillon-Vesque, E. Kramarsky-Winter, A. Vardi, R. Stocker. (2014). Vortical ciliary flows actively enhance mass transport in reef corals. Proc Natl Acad Sci U S A. 2014 Sep 16;111(37):13391-6.
41. M. Schutter, J. Crocker, A. Paijmans, M. Janse, R. Osinga, A. J. Verreth, R. H. Wijffels. (2010). The effect of different flow regimes on the growth and metabolic rates of the scleractinian coral Galaxea fascicularis. Coral Reefs 29, 737–748.
42. K. P. Sebens, B. Helmuth, E. Carrington, B. Agius. (2003). Effects of water flow on growth and energetics of the scleractinian coral Agaricia tenuifolia in Belize. Coral Reefs 22, 35–47.
43. C. D. Storlazzi, A. S. Ogston, M. H. Bothner, M. E. Field, M. K. Presto. (2004). Wave- and tidally-driven flow and sediment flux across a fringing coral reef: Southern Molokai, Hawaii, Continental Shelf Research, Volume 24, Issue 12, Pages 1397-1419.
44. F. Solstorm, D. Solstorm, F. Oppeda, A. Fernö, T. Fraser, R. Olsen. (2015). Fast water currents reduce production performance of post-smolt Atlantic salmon Salmo salar. Aquaculture Environment Interactions. 7. 125-134.
45. A. Taniguchi, S. Nishimura, M. Eguchi. (2024). Coral mucus effects on bacterial growth, respiration, and grazing mortality in reef systems. Journal of Experimental Marine Biology and Ecology, Volume 573,152003.
46. H. Wu , Y. Yamada , P-S. Chuang, K. Ishikawa, S. Mitarai. (2024). Effects of flows on transparent exopolymer particles released from branching Acropora coral colonies. Front. Mar. Sci. 11:1404526.
47. T. Wijgerde, P. Spijkers, E. Karruppannan, J. A. J. Verreth, R. Osinga. (2012). Water Flow Affects Zooplankton Feeding by the Scleractinian Coral Galaxea fascicularis on a Polyp and Colony Level, Journal of Marine Sciences, 2012, 854849, 7 pages.
48. J. Charles Delbeek, Julian Sprung. (2005). The Reef Aquarium: Science, Art, and Technology. Miami Gardens, FL: Ricordea Publishing.
49. Stephen Spotte. (1991). Captive Seawater Fishes: Science and Technology. Wiley-Interscience.
50. Svein A. Fosså, Alf Jacob Nilsen. (1996). The Modern Coral Reef Aquarium, Volume 1. Birgit Schmettkamp Verlag.
最後編輯:
