這篇文章會將一些海水缸飼養時常會用到的數據做個介紹,並簡單解釋一下不同參數的意義、控制手法、以及對生物的影響。
一些我認為對一般玩家而言比較不是重點的數據(講白了就是你不認識也沒差)以及一些落落長的解釋和化學式就不會講太多了,不過有什麼其他想補充或有興趣的也都可以留言討論。
想要更深入的話可以去讀Randy Holmes-Farley的文章,若英文不擅長也可以先從Ruder大整理的筆記開始。
一、溫度
1. 簡介
溫度決定了熱能的流向。生物體內大半的生化反應都會受溫度調控,若是偏離了適當的範圍自然會影響到生物的健康甚至導致死亡(用白話講就是太熱會熱死太冷會冷死),因此維持環境溫度毫無疑問是飼養任何東西的基礎。
溫度過高所造成的傷害往往會比過低更急性。高溫雖然能加速生物的新成代謝,但也會讓水中的溶氧下降增加缺氧風險以及使微生物量增加導致感染風險上升,且由於代謝速率增加,生物的耗氧量也會更快,因此在停電或溫控失靈等事故發生時也更容易產生連鎖反應造成快速倒缸。
2. 維持範圍
不同物種自然會有不同的溫度偏好,所以最直接的做法就是去看看他們生存的自然環境。絕大多數我們飼養的觀賞海洋生物都是生長在副熱帶到熱帶的50米內淺海區域,因此水溫多半會落在攝氏20到30度這個區間內,並大致隨著緯度及水深的增加而降低,當然如果你養的是溫帶甚至寒帶生物或深海生物那自然就得把溫度維持得更低了。

(來源:https://data.aims.gov.au/aimsrtds/yearlytrends.xhtml)
若實際去查不同海域的溫度會發現其實幾乎所有地方的水溫都會隨著季節有很大幅度的變化。上圖為大堡礁南部海域測站的七年平均溫度資料(許多我們飼養的LPS就是來自這個區域),可以看到從冬天到夏天的溫差可以差到近十度,所以多數生物對溫度還是會有一定的適應力。
通常為求方便以及為了盡量同時顧及到來自不同環境的生物我們會將溫度終年穩定在一個中間範圍。多數玩家會選擇將溫度維持在攝氏24~28度這個大多珊瑚礁生物都能接受的區間並盡可能減少變動以避免生物要不斷適應。不過當然也不用太過追求絕對的恆定,一天內約一兩度的波動基本上完全可以不用擔心,甚至有些生物的繁殖還會需要溫度的變動來調控。另外長期沒有變化也可能使生物在突發狀況發生時對變動的耐受度下降,因此太過穩定也不見得是好事[8]。
還有個常見的迷思是純養魚就不用擔心高溫,只有養珊瑚才要。但魚類等構造較複雜的生物對於過高溫度的反應也只是不會馬上體現而已,長期下來依然會造成健康上的影響以及增加染病風險,所以若有打算用心照顧他們的話還是把這項基本參數顧好吧。
3. 測量
要談如何控制溫度前還有個重點便是測量。一般玩家很少會使用準確校正過的實驗規格溫度計,實際上當然也沒這個必要,不過我會建議最少要有三種以上的測量設備在手邊(誤差一定會有,因此重點是範圍及趨勢),並隨時關注生物表現以避免溫水煮青蛙的狀況發生。
4. 加溫
以臺灣的氣候來說其實一年中會需要加溫的日子真的不多(除非你住山上),而且一般的缸中往往也會有馬達等額外的熱源會貢獻一些熱能。最常見的加溫器材就是加溫棒,類型包含玻璃、陶瓷、及鈦製。選購時請注意加溫棒是否有溫控功能,若無則需額外使用溫控器,也可以選擇本身可溫控的加溫棒將設定溫度調至略高於目標作為保險,並使用外加溫控器來做主要的控制。不過加溫棒由於成本相對低所以算是很容易遇上品質問題的水族產品,因此長期使用時最好多注意一下是否有破損並在情況許可下盡量多上點保險(e.g. 外加溫控、使用複數根加溫棒等)。
5. 降溫
降溫對許多新入坑的玩家而言可能會是個比較大的坎,因為降溫設備多半比較不像加溫棒那樣淺顯易懂又價格低廉。常見降溫手段包含蒸發散熱、壓縮機式冷卻、及晶片式冷卻。
蒸發散熱最常見的設備便是風扇,算是價格最低廉的選擇。其表現相當受環境的溼度影響且降溫幅度也較為有限,因此多半使用在不需降太低溫的缸或是小缸並配合自動補水以補充蒸發的水量。一些戶外養殖也會採用大型的冷卻水塔提升蒸發散熱效率,但在一般居家養殖則較難以應用。
壓縮機式冷卻是一般使用範圍最廣的冷卻手法,原理就跟你家的冷氣和冰箱一樣,是利用冷媒的相態轉換來將熱排出。市面上有許多水族用的壓縮機式冷水機,缺點是若機台放置在室內其廢熱會直接往周遭排造成室溫上升;另外一個選擇是分離式冷水機,其構造基本上就是把一般分離式冷氣的室內機改成鈦管來在缸內做熱交換,好處是廢熱會排到戶外,但安裝時就得考慮到如何配置散熱管路及室外機。
晶片式冷水機是利用半導體製冷晶片以電位差產生溫差來轉移熱能。優點是設備體積及噪音都不大,但常見的市售產品往往無法處理太大的水量,因此較常被使用在50L以下的小缸。
6. 其他控溫要點
除了主動式的加溫或降溫外,也有一些額外的小技巧可以協助控溫。冬天時可以透過幫缸子加蓋的方式來減少蒸發進而維持溫度(不過也要注意氣體交換),反之盡量增加水面擾動及減少缸內熱源則可以降低一些降溫的需求。環境因素也是控溫時一個很大的考量,所以選擇缸子的位置也是一個控溫的手段。也因此像是「養海水缸需不需要冷水機?」這種問題坦白講完全沒有意義,因為同樣的缸子養在終年恆溫的空調房和風吹日曬的陽台所需的控溫設備當然不會一樣。
另外有條件的話也可以幫溫控額外上點保險,例如增加有警示功能的監控器或同時讓降溫及加溫設備在缸內待機以避免任一個突然發神經等都是常見的做法。
二、鹽度
1. 簡介
鹽度最白話的解釋就是水裡有多少鹽。鹽除了會讓水變鹹外也會影響到滲透壓(鹽度越高滲透壓越高),而這對生物來說是項很重要的因子。水會從滲透壓低的地方往高的地方流,這也是為什麼喝海水會導致脫水,因為滲透壓高於我們體液的海水反而會讓體內的水分加速流失。魚類等構造較複雜的動物會有一系列的機制來維持體內滲透壓在固定值,因此在進入滲透壓不同的環境時他們會需要一點時間來調控體內的平衡;反之像珊瑚這類構造簡單的動物則是直接讓體內滲透壓與外界一致,因此就沒有太多複雜的調控了。
鹽度同時也決定了之後會提到的絕大多參數,因為鹽度基本上可以說是水中各種東西的總和。常常會聽到有人一值無法釐清為何缸子內某項數據有異常,但最後卻是發現根本鹽度就已經跑掉了,所以在探討其他數據前請至少先將鹽度給搞定吧。
2. 維持範圍
比起鹽度,在水族界中可能會更常聽到「比重」這個詞,然而鹽度(salinity)和比重(specific gravity)雖然有一些關聯性但本質上是兩項完全不同的參數。 鹽度是濃度的計量(多少水裡有多少鹽),常用單位為ppt(每公斤的水裡有多少公克的鹽);而比重則是在一溫度下溶液和純水的密度比,也因為是比值所以不會有單位。我們通常需要的是鹽度而非比重,只是早期由於測量技術限制只能利用比重來回推該溫度下的鹽度所以常常被混為一談。
和溫度一樣,不同海域的鹽度也有可能有很大的差異,例如紅海這種半封閉海域可能會到近40ppt,而一些河口區域則可能只有30ppt。一般以珊瑚礁生物為主的缸子多半會維持在33~35 ppt這個區間,不過一些純養魚的玩家可能會將鹽度降到25~30 ppt來減少魚類維持滲透壓所需的耗能(因為海水滲透壓是高於魚類體內的)。
由於鹽度牽涉到許多其他數據,通常在選定了一個區間後就不會再做什麼變動了,且除了河口外的多數野外環境的鹽度也不太會有大幅度的波動。另外在往缸子放入新的魚類、節肢動物、軟體動物等對滲透壓變動較敏感的生物的話最好注意一下來源處的鹽度,若差異太大可能就得花多一點的時間對水(珊瑚或海葵這些就比較沒差了)。
3. 測量
唯一能直接測量鹽度的方法是將水煮乾然後秤剩下多少鹽,但這顯然並不怎麼實際,因此測量鹽度的設備多半是利用其他有關聯性的參數來回推。常用的測量方法包含比重、折射率、以及導電度,不過這些數據也都會受到溫度的影響(鹽度本身不會)因此得將這點考量到換算的公式內(也就是溫度補償)。
市售比重計大致有浮標式及指針式兩種,價格相對較低,由於是機械式測量所以使用時須注意是否有污漬或氣泡的影響造成失準;折射率測量有肉眼辨識及電子辨識兩類,使用時最好先讓水樣與環境溫度平衡30秒到1分鐘並注意設備是否為設計給海水使用以及不同溫度下不同的對照值(有些產品會有表可對,電子式則多半會內建補償換算);導電度測量的好處是方便快速,但缺點是設備的品質有不小的落差且比起其他兩者可能會需要更常校正。另外無論是使用哪種測量方式請務必確認設備有被正確維護並至少以RO水清潔過後放乾,因為除了導電度外測量鹽度時所使用的水體多半很小,因此相當容易受鹽漬或淡水的污染而影響測量。
4. 校正
比起溫度,鹽度的測量設備就好校正很多了,因此我強烈建議無論使用哪種原理的鹽度計最好都要頻繁校正。校正與歸零的概念其實不太一樣,以鹽度計而言歸零多半就是直接用淡水即可,但校正的話則最好選用與目標鹽度接近的溶液。市面上可以買到一些35 ppt的標準液,你也可以自己買電子秤及氯化鈉來配或直接去你信得過的水族館與他們的缸子對照。
5. 控制手法
如果你是使用人工海水的話基本上就是鹽度低了就加鹽然後高了就補淡水(有生物的話得注意別讓太大量的鹽在缸內一此性溶解),但天然海水就只能做稀釋或慢慢等水蒸發了(當然你要直接加海水素也行)。有些人會去計算要用多少體積或重量的鹽來調多少的鹽度,不過即使你算的很精確還是有可能因為受潮等因素影響,所以最好還是測一下做確認。
另外切記水蒸發是會提升鹽度的(鹽不會蒸發),因此補水這件事對於維持鹽度來說至關重要。若你的缸子比較沒有散熱問題的話也可以透過加蓋來減少蒸發延長補水區間(但還是得注意氣體交換別完全封死),不過除非你完全不會出遠門不然最好還是準備某種形式的自動補水。
三、pH
1. 簡介
pH在中文我們也常將其稱之為酸鹼值,代表的是溶液中氫離子和氫氧根離子的相對關係,其數值的定義為溶液中的氫離子濃度取log後乘上負號(pH中的H即為氫離子)。
如果數學都已經忘光了也沒關係,簡單來講若一溶液有10的負五次方(0.0001)莫耳濃度的氫離子,換算為pH值便會是5,也就是說pH越低氫離子濃度就越高(溶液越酸),pH越高則氫離子濃度越低(溶液越鹼),而若氫離子和氫氧根離子的濃度相等的話則稱為中性(在攝氏25度時pH=7為中性)。
pH同樣調控著諸多生物體內的生化反應,因此若偏離太多也是會影響生物的健康或直接造成死亡。此外,無論是生物性或非生物性的鈣化都會隨這pH上升而速率加快,反之pH過低則有可能反過來使碳酸鈣結構開始溶解(pH越低碳酸鈣溶解度越高),因此對於像珊瑚這類會建構碳酸鈣骨骼的生物來說pH高自然可以長得比較快,不過一些發生在馬達等設備上的鈣化也會增加所以也得注意是否影響運轉。
2. 維持範圍
海洋中的pH值平均約在8.0~8.3之間,而一般缸子如果落在7.8~8.5的範疇內我就不會太擔心了。有些玩家會刻意追求高pH來加速珊瑚的生長,不過這同時也會提升各種離子及養分等的消耗量以及增加部分毒素的毒性,因此若沒有相應做出調整甚至可能產生反效果。 二氧化碳溶於水中所形成的碳酸也是個影響pH值的重要因子,因此通常在關燈後由於光合作用(消耗二氧化碳)的減少pH也會隨之降低,不過只要都還落在合理範圍內就不用太緊張。
另外長時間運輸生物時也有可能因為在封閉包裝內碳酸堆積所造成pH降低,因此在下缸時可以注意一下袋中pH是否有掉得太誇張並視情況調整對水流程(尤其是魚蝦等構造較複雜的動物)。不過我倒是並沒有找到什麼證據表明在正常範圍內的pH變動到底有什麼影響,甚至還有部分研究認為一定程度的pH變動對珊瑚可能是有幫助的[9]。
3. 測量
常見的pH測量方式包含了指示劑以及電極。pH指示劑的成分為會隨著pH值不同而呈現不同顏色的物質,一般市售測試劑及測試紙便是利用此原理,不過缺點是其測量精度可能不太夠且也有藥劑變質及顏色分辨的問題,因此多半只會拿來粗略抓一下範圍。
如果要更精確的量測pH比較主流的方法是使用pH電極。pH電極的原理是利用溶液中氫離子的電位來推算出pH值,不過由於pH會受到溫度影響因此也是需要進行溫度補償。市面上有許多pH測量儀器可供選擇,不過選購時記得先注意一下設備適用的電極、pH範圍、以及測量目標並看看產品的溫度補償和校正功能是否符合你的需求。
電極在使用前必須被校正(平常最好也要固定校正)。常見的pH校正液包含pH4、7、10等,以一般海水缸用途而言建議選擇能以pH7或10校正液兩點校正的設備並注意校正液的使用期限。另外pH電極也是消耗品因此得定期更換,平時也需要保存在緩衝液(通常是KCl溶液)中不能讓其乾掉,而若是長期放在缸中監控的電極最好也要定時清潔避免生物或污垢附著影響測量結果(多數電極不能被擦拭故只能以純水潤洗)。
4. 控制手法
以海水缸而言其實多半只要維持好KH值(後面會介紹)pH就不會跑得太誇張了,因此也有不少玩家是完全不管pH的,而若真的想在pH上下點功夫請至少先確認你的測量結果是準確可信賴的(由於pH是取log後的結果,僅僅0.3的不同的實際上已經是近兩倍的氫離子濃度差異了)。
若是遇到pH長期偏低的情況我會先往碳酸累積的方向去思考。原因有可能是缸內有太多生物或濾材砂石在行呼吸作用產生二氧化碳、缸子所處位置的二氧化碳濃度太高(通常是室內或是人多的地方)、或是有使用鈣反等會往缸內打CO2的設備。如果是缸內問題最簡單的做法就是減少生物密度、移除一些濾材及汙泥、或是加強缸子的氣體交換(e.g. 水面擾動、蛋白機等);若是環境因素則可以嘗試開窗通風、將蛋白機的進氣引至室外。也有些人會使用二氧化碳吸附劑或藻缸來移除CO2、抑或是添加氫氧化鈣來將碳酸轉為碳酸根或碳酸氫根使其能被鈣化利用(同樣會在後面介紹),不過這些方式就得衡量一下成本或是空間是否允許。至於pH太高的狀況則較少見,多半是因為有某種添加劑或缸內的物質(e.g. 水泥)在提升pH,因此若有發生可以往這方面去注意。
另外我再補充幾個常見的誤解。首先,溶氧量和pH沒有直接關係!這個觀念應該是來自大家把呼吸作用的原料及產物概念搞混了,因為實際影響pH的是二氧化碳(產物)而非氧氣(原料);另外一項誤解是很多人會認為珊瑚砂等碳酸鈣材質的底質能提升pH,然而這些材質頂多就是做為一點緩衝,對pH接近8的海水缸而言並沒有太多提升的作用,而且隨著生物膜、有機物、以及鎂離子等附著在表面上這些砂石會在幾個月內失去大半的緩衝能力,甚至反而有可能因為裡頭的大量微生物不斷呼吸產生二氧化碳及各種生物作用產生的酸化而對pH有負面的影響[17]。
四、KH
1. 簡介
一般我們講的KH比較準確的說法應該叫做「鹼度」,而KH這個稱呼則是來自於鹼度的德制單位dKH(deutsche Karbonathärte),其定義為溶液對酸的緩衝能力,也就是說當溶液的鹼度越高就需要越多的酸才能降低其pH。鹼度通常是由許多有緩衝能力的離子如 HPO4 2-、 PO4 3-、H2BO3- 、HCO3-、CO3 2-等一起貢獻的而非單一一種離子,不過在海水中最主要的貢獻者是碳酸(H2CO3)、碳酸氫根離子(HCO3-)、以及碳酸根離子(CO3 2-)這三兄弟,也因此KH又有「碳酸鹽硬度」這個稱呼(也就是dKH的德語意思)。這三者之間為共軛酸鹼對的關係,也就是說它們能藉由丟出或接收氫離子的方式來互相轉換,而所謂的pH緩衝效果也是由此而來(等於說多了一個倉庫來存放氫離子)。
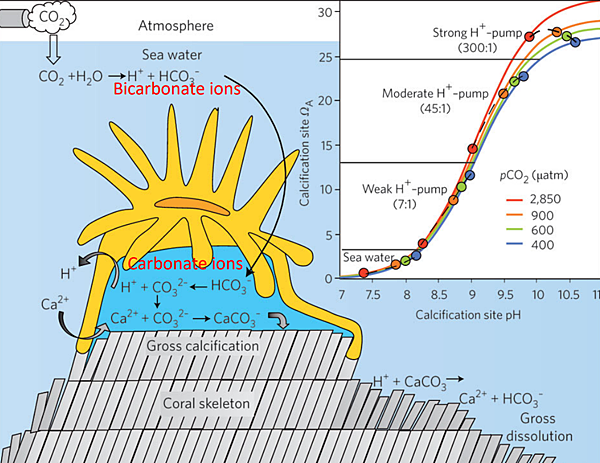
(來源: https://www.researchgate.net/public...of_ocean_acidification_on_marine_biodiversity)
了解了緩衝系統後應該就能理解為何前面會說只要顧好KH就不用太擔心pH了,然而除此之外KH對缸中生物而言還有許多影響。首先,鈣化作用在形成碳酸鈣時也會消耗碳酸鹽。上圖為珊瑚在分泌碳酸鈣骨骼時的過程,可以看到其原料便是鈣離子和碳酸氫根,並且由於過程中還要排除氫離子故水體pH越高鈣化的效率也會越好(如同前面在pH那邊所提的)。
此外,碳酸氫根對於很多自營生物來說也是一項可利用的無機碳源(Dissolved Inorganic Carbon, DIC) 。很多自營生物例如植物、藻類、硝化菌等都能利用碳酸酐酶(Carbonic anhydrase)將碳酸氫根轉換為 CO2 利用,這也是為什麼大家常說老缸子的旺盛的硝化及光合作用很吃KH(編輯: 光合作用不會消耗KH)。

(來源:https://www.researchgate.net/publication/266077973_Response_of_benthic_foraminifera_to_ocean_acidification_and_impact_on_Florida's_carbonate_sediment_production)
上圖為不同pH值時碳酸鹽系統的平衡比例,可以看到在一般海水pH值時比例最高的是碳酸氫根,而多數生物也是以它為主要利用對象
2. 維持範圍
除了dKH外,鹼度也常被以meq/L(當量)或ppm(碳酸鈣濃度)來表示,但為求方便我基本上都會用dKH來介紹。
KH在天然海水中大約落在6~7dKH,然而究竟要維持缸子的KH在什麼數據每個人可能都有不同的習慣,一般比較常見的數據多半在7~11dKH之間。過低的KH除了會減緩鈣化及光合作用外也會使pH更容易變動。反之較高的KH則能加速光合作用及鈣化的效率使珊瑚等生物長得比較快[10, 12],但由於生物性與非生物性的鈣化速率都會增加因此除了KH消耗外也得注意鈣的消耗以及碳酸鈣沉澱。另外也有不少玩家回報若缸中的營養鹽濃度偏低的話高KH(>9)有可能造成Acropora等珊瑚出現分枝頂端脫皮的狀況(俗稱燒頂)但其機制尚未完全明瞭,不過如果擔心的話也可以將KH維持在7~8dKH的範圍就好[1]。
此外也有許多人會去追求KH的穩定。這大方向來說我不覺得有什麼問題,畢竟在一個成熟的系統中KH確實是個消耗量很大又容易變動的參數,但我倒不認為有必要徹底鎖在一個固定值上。穩定是一個長期的趨勢,若是整天在數據上鑽牛角尖反而還更容易出亂子。我自己是習慣大概抓1dKH的範圍,比如7~8或9~10,只要測出來有在範圍內就行了。
3. 測量
最常見的KH測量方式是利用滴定法。其原理簡單來說就是利用到達特定pH就會變色的酸鹼指示劑或是pH電極來測量樣本pH,然後再往樣本裏頭開始滴定某種酸,等到pH到達目標後停止並記錄加了多少酸,若是加越多就代表KH越高(緩衝能力越強)。另外也有一些設備會反過來把加入的酸固定並看pH改變多少來計算KH(例如HANNA或KHG的比色法)或是直接量樣本與大氣平衡後的pH並用空氣CO2含量來回推KH(如KHA)。
KH通常比較少人會刻意準備標準液來校正,但我還是會建議至少偶爾用剛泡好的海水等大致知道範圍的溶液稍微檢查一下並注意pH電極的維護(若是用電極測量的話),而如果是使用自動測量的設備也最好定時手測一下做個對照。
4. 控制手法
由於碳酸氫根很容易被生物消耗,多數缸子的KH會需要某種補充的方式,以下我會分別做個簡單的介紹。
(1) 換水
如果你的缸子很小可以頻繁的大量換水或是你得生物對KH的需求及要求沒那麼高的話換水也是一個可行的做法(也有一些人會選擇高KH的海水素來減少換水的比例),不過若缸子或生物消耗量大到一定程度的話基本上就不太可能靠換水維持住適當的KH了。
(2) 碳酸鈉(蘇打)&碳酸氫鈉(小蘇打)
這個方法應該是最直觀也最泛用的,許多市售的KH補充劑其實也只是這兩種鹽類的水溶液,因此若想省錢的話也可以直接買原料加,不過就得注意藥品的品質及純度。碳酸鈉與碳酸氫鈉的差別在於前者在添加時有短暫提升pH的效果,因此若有pH偏低的狀況也可以做為輔助。另外若添加頻率較高的話也可以用滴定(蠕動馬達)自動添加,不過要注意得盡量和其他金屬離子添加劑(如氯化鈣)同時添加避免沉澱,且若長期使用可能會導致鈉離子的累積因此得適當換水來稀釋。
(3) 氫氧化鈣
氫氧化鈣的原理是利用氫氧根去與缸內既有的碳酸結合形成碳酸氫根提升KH。氫氧化鈣同時也能補充鈣離子及提升pH,不過添加時得注意不能一次加太大量以避免pH驟升使碳酸鈣沉澱(就白加了),而且由於氫氧化鈣的溶解度不高所以也得小心別加超過一天的蒸發量。另外添加氫氧化鈣時多半加入的是混合後的澄清溶液,而這可以透過事先混好等溶液沉澱或是使用鈣水攪拌器來達成,並且要盡量避免儲存的溶液及粉末與空氣接觸而與二氧化碳形成碳酸鈣導致效果降低。
(4) 鈣反應器
鈣反應器的原理是將缸內水導入一裝有珊瑚砂等碳酸鈣材質的密閉容器中並往裡頭打CO2降低pH將碳酸鈣溶回碳酸氫根和鈣離子(和鈣化反過來),因此與氫氧化鈣一樣能同時補充KH和鈣但卻會反過來降低pH。鈣反應器多半使用在石珊瑚密度很高的大型缸,因為它的耗材本身的成本最低(碳酸鈣&CO2),但由於調整及操作都較多細節要注意且初始設置成本高故多半是較有經驗的玩家在使用。
(5) 甲酸鈣&乙酸鈣
部分市售產品如TM All For Reef(甲酸鈣)或Salifert All In One(乙酸鈣)就是使用這個方法。這兩種鹽類補充KH的方式是透過缸內的微生物作用將甲酸根或乙酸根氧化為碳酸氫根,並且可同時補充鈣,不過由於需經過微生物作用故KH提升效果並不會馬上出現而且過程中也會耗氧並產生CO2降低pH(基本上也是一種有機碳源)。
(6) 降KH
KH過高的情形則多半只要慢慢等生物消耗降下來即可,不過若真的有急需的話一般會使用鹽酸,但請注意個人及生物的安全。KH過高的除了添加過多或水源問題外最常見的大概就是缸子裡有水泥製品;另外若有大量硝酸鹽被還原時(脫氮作用或細菌、藻類藻類等的同化作用)KH也可能上升,不過這狀況就比較少見了[11]。
五、鈣離子(Ca)
1. 簡介
鈣離子在神經傳導、調控酵素活性等諸多基礎生化作用中都扮演著很重要角色,但在海水缸中我們最常提到的用途便是鈣化。
珊瑚、軟體動物、節肢動物等動物的外殼或骨骼成分有很大一部分就是碳酸鈣(我們脊椎動物的硬骨則是磷酸鈣),因此維持水體中足夠的濃度(鈣離子&碳酸氫根離子)自然相當重要,尤其是許多海洋生物又會比起淡水生物還更仰賴從環境吸收這些原料。
2. 維持範圍
海洋中的鈣離子濃度大致在380ppm~480ppm之間,而一般的海水缸也多半會選擇維持在這個範圍。
鈣的濃度和KH一樣和鈣化速度有一定的關係[13],不過高濃度的鈣也會增加沉澱機率以及使KH的維持變得困難;至於過低的鈣濃度除了影響珊瑚等鈣化生物的成長外也有可能使蝦蟹等節肢動物發生脫殼不順的狀況。
3. 測量
市面上多數的鈣離子測試劑的原理是先利用某種會和鈣離子結合變色的指示劑與樣本中的鈣結合變色,接著再以EDTA等螯合劑滴定去把指示劑上的鈣搶走讓其顏色變回來,然後再看滴了多少螯合劑變色來推斷鈣濃度。這個測試方法其實和鎂離子測試劑以及淡水常用到的GH測試劑幾乎是一樣的原理,差別只是在要怎麼排除測試目標以外的金屬離子的影響。也有一些使用比色法的產品是透過修改不同的螯合劑及指示劑來達到效果,不過基本邏輯還是一樣。例如Hanna便是使用zincon method讓樣本中的鈣去替換掉測試劑中EGTA上的鋅,並改成以與鋅結合會變色的物質做指示劑來看有多少鋅被換出來。
另外市面上也有一些鈣離子測試儀器是利用離子選擇性電極直接測量溶液中鈣離子的電勢,如Pinpoint和Hanna都有類似的產品,不過由於價位較高相對就比較少玩家使用了。
4. 控制手法
換水、氫氧化鈣、鈣反、甲酸鈣&乙酸鈣等同時補充KH及鈣的方法我在上面已經提過了所以就不多做贅述。
至於單獨提升鈣離子的方法最常見的就是使用氯化鈣,不過若是以原料添加的話同樣須注意品質、別與碳酸鈉or碳酸氫鈉一起加、適當換水避免氯離子過度累積、並看一下你用的是無水還是含水的氯化鈣(添加量會不太一樣)。
六、鎂離子(Mg)
1. 簡介
鎂離子同樣參與了許多生化作用,而在海水缸中它主要會被光合作用以及鈣化過程消耗。葉綠素的基本結構中就包含了鎂,因此藻類等光合作用生物生長時自然會需要其作為原料;另外雖然比例遠不及鈣但許多生物在鈣化時也是會把鎂一起併入骨骼,例如鈣藻在生長時相對其他鈣化生物就會使用更多的鎂。
除了單純的生物性鈣化外鎂還有另一項很重要的功能,那就是維持海水中碳酸鈣的過飽和狀態。海水中的碳酸鈣濃度若在一般狀況下其實早該沉澱了,不過之所以沒有發生最大的原因便是鎂離子。鎂離子的角色有點類似電燈泡,當鈣離子與碳酸根或碳酸氫根形成碳酸鈣結晶時鎂也會一起黏到表面上阻止更進一步的結晶發生,因此若你發現缸子裡的鈣及KH怎麼拉都拉不起來的話有可能就是鎂太低導致加進去的鈣及碳酸鹽都直接沉澱掉了。
2. 維持範圍
海洋中的鎂離子濃度通常會落在1200ppm~1300ppm,而在海水缸中有時會維持的稍微高一點(1200ppm~1500ppm)來增加緩衝。過低濃度的鎂離子除了會增加維持KH和鈣的難度外,也有一些玩家發現特定種類的珊瑚(如一些Montipora)的健康狀況可能會受影響[3]。
3. 測量
常見的鎂離子測試劑的原理基本上和多數鈣離子測試劑差不多,也是利用螯合劑與指示劑的搭配來行滴定法,但由於EDTA等螯合劑對鈣離子的親和能力較強故多半得透過不同的方式排除鈣離子的影響,不過也是可以反過來利用這點以螯合劑處理掉鈣離子後在單純以指示劑的變色狀況來做比色法。
4. 控制手法
補充鎂離子常用的藥品為氯化鎂及硫酸鎂,而使用注意事項則和上述其他添加劑相同(無水氯化鎂由於溶解時會放出大量的熱故較少被使用)。
七、總氨(NH3/4+)
1. 簡介
這裡的總氨指的是水體中分子態氨(NH3)與離子態的銨根離子(NH4+)的總和,算是在水族飼養中最常被提及的毒素之一。
幾乎所有生物在代謝胺基酸或蛋白質時都會產生氨,不過氨對於生物體多半具有毒性,因此得想辦法將其排除。我們哺乳類多半是在肝臟將氨轉化為毒性較低的尿素再隨泌尿系統排出,而魚等水生生物或構造簡單的生物則通常是直接利用擴散作用排出氨。缸子裡的殘餌、大便、或死亡生物的屍體會造成水體汙染的主因也因為這些東西多半含有不少含氮有機物,所以隨著被環境中的各種微生物分解便會產生氨。
水體中的氨多半會以毒性較低的銨根離子的形式存在,不過NH3及NH4+之間的比例是受到pH決定的,pH越高NH3的比例就越高。pH在小於7時所有的氨都會轉為銨根離子故在酸性水中幾乎不太需要擔心氨的毒害,然而在鹼性的海水中氨的毒性就會大增了。
2. 維持範圍
海洋中的總氨濃度多半會在0.1ppm以下。至於在穩定的養殖系統中,氨則基本上是不太應該被一般的肉眼比色型測試劑測到。
不同生物對氨的耐受性不太一樣。 若實際從氨的毒性機制來看,環境中低濃度的氨最主要影響是魚類等生物的鰓,造成上面的離子運輸異常與黏膜增生降低表面積而使其缺氧;不過如果是像珊瑚這類構造簡單的生物反而不容易被氨傷到,因為牠們沒有有鰓這種為了呼吸特化的超高表面積器官,甚至連血液與循環系統都沒有,僅僅只靠簡單的擴散作用處理物質運輸,甚至在適當的濃度下還能將其作為養分吸收利用。
3. 測量
常見的總氨測試劑是利用次氯酸根與酚和氨形成藍綠色化和物後進行比色,另外也有一些市售的電子設備能分別測試NH3或NH4+。不過要注意使用的方法量的究竟是離子態、分子態、還是總氨,進行換算則須將pH也考慮進來。
4. 控制手法
利用微生物的硝化作用來處理氨算是水族箱中最常被提到的手法。除此之外植物、藻類、細菌、甚至珊瑚等生物也都可以將銨根離子作為氮源吸收(甚至還有人會以氯化銨或氨水人工添加),因此在穩定的老缸中多半就比較不會去關注這項數據了。
另外淡水缸中常用的吸氨沸石等離子交換濾材在海水中幾乎沒有任何作用,因為海水中有超高濃度的鈉鉀離子競爭,所以對於低濃度的銨很難發揮到交換的效果。
八、亞硝酸鹽(NO2)
1. 簡介
亞硝酸鹽或是說亞硝酸根離子是硝化作用的中間產物,雖然同樣具有毒性不過在海水中由於高濃度的氯離子影響所以在一般海水缸中幾乎很難毒害到生物。
亞硝酸根是藉由魚類平衡滲透壓的氯細胞(chloride cell/ionocyte)穿透鰓進入魚體,並在血液中與血紅素結合,使血液運送氧的能力下降。不過海水魚的氯細胞類型與淡水魚不太一樣,主要負責的是將體內氯離子向外丟(淡水魚的氯細胞則主要是負責攝入氯離子),所以亞硝酸鹽自然就難以跟著氯離子進入海水魚體內了。
2. 維持範圍&控制手法
在穩定的缸子中亞硝酸鹽基本上也不太應該被測出來,不過假使有什麼突發狀況導致亞硝酸鹽上升的話倒也不用太緊張因為這東西在海水中根本很難弄死生物,把重心放在氨還比較實際。
3. 測量
常見的亞硝酸鹽的測量方法為利用磺胺與亞硝酸根行重氮反應後再與N-(1-Naphthyl)ethylenediamine形成偶氮染料做比色法。
九、硝酸鹽(NO3)
1. 簡介
硝酸鹽為硝化作用的最終產物,比起常被當作毒素看待的氨和亞硝酸鹽,硝酸鹽最常被討論的反倒是其作為養分與肥料的角色,而一般我們提到營養鹽或NP時多半也就是指硝酸鹽及磷酸鹽(銨及亞硝酸鹽其實也算營養鹽)。
2. 維持範圍
海洋中的硝酸鹽通常會在1ppm以下(依地區而異),但不同玩家的海水缸硝酸鹽濃度就有很大的差異了。從低到無法以測試劑測得一路到接近100ppm的誇張濃度我有都見過能將多數生物養的不錯的缸子,不過多數人比較能接受的範圍大致會在20ppm以下。
目前的研究對於硝酸鹽等營養鹽對不同生物的上限值到底在哪裡以及究竟會有什麼直接的生理影響其實也還沒有個定論[14],不過我也並不建議去追求這些極端數值,畢竟不同生物的適應能力多少也有差。高濃度硝酸鹽對生物的影響目前已知的多半是比較間接性的,例如加速缸內的藻類或其他微生物的生長或是使珊瑚的共生藻增加影響顏色等。
至於多低的硝酸鹽才是太低則是取決於你缸內是否有其他類型的養分。珊瑚確實是會藉由共生藻來間接利用硝酸鹽等營養鹽,但這不代表這是他們唯一的養分獲取手段。如果你所飼養的生物(這邊主要是指珊瑚)可以透過直接餵食等方式獲得所需的養分的話那水體中的營養鹽濃度可能就不是那麼重要了;反之如果其他的養分來源不足的話那水體中過低的營養鹽就有可能影響到健康了。
不過測試劑無法測得也不見得代表你缸中營養鹽就一定不足。測試劑的靈敏度問題當然是一個可能性,不過另一種狀況是你缸中營養鹽在產出後馬上就被生物用掉了所以不會在水中停留太久,因此當缸內營養鹽處於低標時生物的狀況可能就會比實際的數值更有參考意義,但如果真的很擔心見底的話也是可以把濃度先維持在至少測試劑還測得出來的程度。
3. 測量
市售硝酸鹽測試劑其實也就只是亞硝酸鹽測試劑再加上鎘粉或鋅粉等還原劑將硝酸鹽還原回亞硝酸鹽,不過也是因為這個原理所以當水中有亞硝酸鹽存在時硝酸鹽測試劑就會失準,因此測試前可以稍微注意一下這點(通常是新缸比較會有這種狀況)。
4. 控制手法
由於多數化學性的濾材吸收硝酸鹽的效率都不太好所以常見的降硝酸鹽手段幾乎都是生物性的。比較直接的方法是依靠藻類或細菌的同化作用讓他們直接吸收硝酸鹽做為肥料,例如藻缸、藻屏、或是添加有機碳源等;或者是利用微生物的脫氮作用將硝酸鹽還原回氧氣與氮氣,例如各式硝酸鹽化除器或是加厚的底沙。
不過其實當缸內有一定密度的珊瑚、餵食量也不過量的話往往也足以讓硝酸鹽維持在很低的數值了,甚至在很多情況下還會需要稍微拉抬濃度。要拉高硝酸鹽其中一個方式就是加強餵食,讓含氮的食物被生物利用代謝後自然轉換為硝酸鹽;或者要更直接一點也可以用硝酸鉀或硝酸鈉等鹽類來人工補充。
十、磷酸鹽(PO4)
1. 簡介
磷和氮一樣都是組成生物體的基本元素,我們的DNA和RNA等遺傳物質、細胞的能量貨幣ATP(adenosine triphosphate)等也都有磷的成分。
我們一般統稱的磷酸鹽算是一系列無機磷的統稱,其中包含了 H3PO4、H2PO4-、HPO4 2-、PO4 3-。磷酸鹽和硝酸鹽一樣也是我們常說的營養鹽之一,因此同樣可被生物作為養分吸收利用,不過水體中可測得的無機磷其實也只占整體磷含量的一部分,其中很多的磷可能是以有機化合物的形式存在或是吸附在其他物質上面(磷酸根很喜歡黏東西)。
磷酸鹽的來源除了含磷有機物在缸中被分解外也常經由水源進入缸中,尤其台灣的自來水往往有不低的磷酸鹽濃度,甚至有些區域即使有使用RO膜也不見得能完全去除。
2. 維持範圍
海洋中的磷酸鹽濃度多半在0.01ppm以下(這邊主要是以PO4 3-為來計算),不過就和硝酸鹽一樣在海水缸中也常看到各式各樣亂七八糟的濃度,而多數人都比較能接受的範圍大致是0.1ppm以下。
磷酸鹽與硝酸鹽一樣若濃度高有可能造成缸內的藻類、微生物、及珊瑚的共生藻增加,不過還有另一項常被討論的是其對鈣化的影響。確實是有研究發現磷酸鹽會影響到鈣化過程,不過對珊瑚來說究竟是正面還是負面的影響其實也還未有個結論, 例如Dunn等人比較了Acropora muricata(長枝)在0.09、0.2、以及0.5ppm的磷酸鹽下的生長,結果發現在0.5ppm下珊瑚的生長速度最快但骨骼密度則有下降,除此之外也沒有觀察到什麼不健康的狀況[15]。至於過低的狀況則和硝酸鹽差不多所以我就不再重複一遍,如果擔心見底的話就一樣維持在測試劑可測得的狀態吧。
3. 測量
市售磷酸鹽測試劑多半採用鉬藍法,其原理為讓磷酸根和鉬酸鹽結合後再以抗壞血酸(維生素C)還原為藍色化和物行比色法。不過由於磷酸鹽在海水缸中一般都維持在相對低的濃度故一般的肉眼比色恐怕很難分辨0.1ppm以下的濃度,因此若希望針對你的數值做任何調整的話最好還是要有比色儀。
4. 控制手法
市面上可以買到很多磷酸鹽吸附劑,其中最常見的成分為氧化鐵(GFO)以及氧化鋁(GAO)。也有些玩家會添加氯化鑭來與磷酸鹽形成沉澱物後以物理過濾濾除,不過這個方法很容易使磷酸鹽快速見底且沉澱物若沒有妥善濾除也可能卡到魚的鰓造成窒息,因此除非你的磷酸鹽真的非常高不然我個人並不推薦將其作為長期維持的方案。而生物性的除磷法主要依賴同化作用,方法則如上面在硝酸鹽那邊所提。另外若在短期內降低磷酸鹽的話最好注意一下KH的消耗,因為無機磷系列的東西同樣也是鹼度的重要組成。
如果是想拉升過低的磷酸鹽的話則一樣可透過增加餵食或以磷酸鉀或磷酸鈉等鹽類補充,不過要注意一下有些單純的胺基酸添加劑對磷酸鹽的增加其實並沒有幫助(生物體內常見胺基酸的結構並不含磷)。
延伸閱讀
如果搞懂了這些參數的意義後想再進一步了解一些細節的話這裡還有一些文章可以參考看看
飼養資料整理
添加劑計算機:
海缸小幫手APP
無機鹽類計算機
KH、鈣、鎂添加計算機
微生物作用:
一些微生物作用的簡介
[基礎觀念]關於硝化系統的一些迷思與誤解
結語
這篇文章的主要目的其實也只是希望能讓人稍微多了解一點數字背後的基本原理。當然也不用搞得像個化學家,但能知道自己的缸子內正在發生什麼事或是加進去的東西到底是幹啥的不也是挺酷的嗎?
似乎有不少人都對「化學」這個詞很反感,也許是各種食安新聞導致的PTSD吧。人往往會對不瞭解的事物心生恐懼,進而產生許多亂七八糟的謠言,而這也是我認為科普很重要的其中一個原因。雖然基礎科學對多數人而言可能比應用科學無聊不少,畢竟比起推陳出新的科技產品這些老知識可能幾百年來都始終如一,然而所謂的創新其實也還是得建立在扎實的基礎上。有時會看到一些入坑根本還沒一兩年的新手就開始在那邊討論什麼氮磷平衡、微量元素、或是菌種競爭之類的東西。當然也不是說不能談啦,但講真的這些主題都可以寫好幾篇博士論文了,如果真的想探討的話起碼先把一些最基礎的東西先鑽研透徹吧。
另外還有一個給新手的小建議那就是不要太過追求數字!雖然我在這邊還是都有附上建議的維持範圍,但以上數據中真的會因為偏離範圍而直接造成生物掛掉的其實也就只有溫度、鹽度、pH、氨這四項而已。這意思當然不是說其他就都不用管了(如果是這樣我也不會寫這篇了......),只是很多時候真正引發災難其實並不是你發現的問題本身而是你急於改善所做出的行動,因此了解原理以及冷靜分析非常重要。如果真的發現了數據不甚理想,我最先會注意的會是生物的狀況,再來才會是去釐清問題所在(也完全有可能是測量問題),而不是看到OO太高就趕快加XX劑。多數生物的適應能力其實遠比我們想得還強,而且即使是海洋也並非所有地方都有一樣的數值,甚至很多環境的震盪幅度還比我們的缸子大,所以也不見得有什麼完美的數據,只有適合你的缸子的數據。
參考資料
1. Optimal Parameters for a Coral Reef Aquarium by Randy Holmes-Farley
2. Saltwater Aquarium Chemistry: How To Supplement Calcium And Alkalinity by Randy Holmes-Farley
3. How To Grow The Most INTENSE Purple Rim Monti Cap by Jake Adams
4. Daily Average Ocean Water Temperatures Against Long Term Average Water Temperature Australian Institute of Marine Science
5. Standard Methods for the Examination of Water and Wastewater
6. Hennige, Sebastian & Roberts, J. & Williamson, Phillip & Aze, T & Barry, J & Bellerby, Richard & Brander, Luke & Byrne, Maria & Gattuso, Jean-Pierre & Gibbs, S & Hansson, Lina & Hattam, Caroline & Hauton, C & Havenhand, Jon & Fosså, JH & Kavanagh, Christopher & Kurihara, Haruko & Matear, Richard & Mark, Felix & Young, Jeremy. (2014). An updated synthesis of the impacts of ocean acidification on marine biodiversity. CBD Technical Series, 75, 1-99.
7. Knorr, Paul. (2014). Response of benthic foraminifera to ocean acidification and impact on Florida's carbonate sediment production.
8. Oliver, T.A., Palumbi, S.R. (2011). Do fluctuating temperature environments elevate coral thermal tolerance? Coral Reefs, 30, 429–440.
9. Comeau, Steeve & Edmunds, Peter & Spindel, Nathan & Carpenter, RC. (2014). Diel pCO2 oscillations modulate the response of the coral Acropora hyacinthus to ocean acidification. Marine Ecology Progress Series. 501. 99-111.
10. Marubini Francesca, Thake Brenda. (1999). Bicarbonate addition promotes coral growth. Limnology and Oceanography, 3.
11. Brewer Peter G. , Goldman Joel C. (1976). Alkalinity changes generated by phytoplankton growth. Limnology and Oceanography, 1.
12. Herfort, L., Thake, B. and Taubner, I. (2008). Bicarbonate stimulation of calcification and photosynthesis in two hermatypic corals. Journal of Phycology, 44, 91-98.
13. Alan T. Marshall, Peta L. Clode. (2002). Effect of increased calcium concentration in sea water on calcification and photosynthesis in the scleractinian coral Galaxea fascicularis. J Exp Biol, 205 (14): 2107–2113.
14. M. C. Buckingham, C. D'Angelo, T. B. Chalk, G. L. Foster, Z. Connelly, C. Olla, M. Saeed & J. Wiedenmann. (2022). Impact of nitrogen (N) and phosphorus (P) enrichment and skewed NP stoichiometry on the skeletal formation and microstructure of symbiotic reef corals. Coral Reefs 41, 1147–1159.
15. Jeremy G. Dunn, Paul W. Sammarco, Gary LaFleur. (2012). Effects of phosphate on growth and skeletal density in the scleractinian coral Acropora muricata: A controlled experimental approach. Journal of Experimental Marine Biology and Ecology, 411, 34-44.
16. J. Charles Delbeek, Julian Sprung. (2005). The Reef Aquarium: Science, Art, and Technology. Miami Gardens, FL: Ricordea Publishing.
17. Stephen Spotte. (1991). Captive Seawater Fishes: Science and Technology. Wiley-Interscience.
一些我認為對一般玩家而言比較不是重點的數據(講白了就是你不認識也沒差)以及一些落落長的解釋和化學式就不會講太多了,不過有什麼其他想補充或有興趣的也都可以留言討論。
想要更深入的話可以去讀Randy Holmes-Farley的文章,若英文不擅長也可以先從Ruder大整理的筆記開始。
一、溫度
1. 簡介
溫度決定了熱能的流向。生物體內大半的生化反應都會受溫度調控,若是偏離了適當的範圍自然會影響到生物的健康甚至導致死亡(用白話講就是太熱會熱死太冷會冷死),因此維持環境溫度毫無疑問是飼養任何東西的基礎。
溫度過高所造成的傷害往往會比過低更急性。高溫雖然能加速生物的新成代謝,但也會讓水中的溶氧下降增加缺氧風險以及使微生物量增加導致感染風險上升,且由於代謝速率增加,生物的耗氧量也會更快,因此在停電或溫控失靈等事故發生時也更容易產生連鎖反應造成快速倒缸。
2. 維持範圍
不同物種自然會有不同的溫度偏好,所以最直接的做法就是去看看他們生存的自然環境。絕大多數我們飼養的觀賞海洋生物都是生長在副熱帶到熱帶的50米內淺海區域,因此水溫多半會落在攝氏20到30度這個區間內,並大致隨著緯度及水深的增加而降低,當然如果你養的是溫帶甚至寒帶生物或深海生物那自然就得把溫度維持得更低了。

(來源:https://data.aims.gov.au/aimsrtds/yearlytrends.xhtml)
若實際去查不同海域的溫度會發現其實幾乎所有地方的水溫都會隨著季節有很大幅度的變化。上圖為大堡礁南部海域測站的七年平均溫度資料(許多我們飼養的LPS就是來自這個區域),可以看到從冬天到夏天的溫差可以差到近十度,所以多數生物對溫度還是會有一定的適應力。
通常為求方便以及為了盡量同時顧及到來自不同環境的生物我們會將溫度終年穩定在一個中間範圍。多數玩家會選擇將溫度維持在攝氏24~28度這個大多珊瑚礁生物都能接受的區間並盡可能減少變動以避免生物要不斷適應。不過當然也不用太過追求絕對的恆定,一天內約一兩度的波動基本上完全可以不用擔心,甚至有些生物的繁殖還會需要溫度的變動來調控。另外長期沒有變化也可能使生物在突發狀況發生時對變動的耐受度下降,因此太過穩定也不見得是好事[8]。
還有個常見的迷思是純養魚就不用擔心高溫,只有養珊瑚才要。但魚類等構造較複雜的生物對於過高溫度的反應也只是不會馬上體現而已,長期下來依然會造成健康上的影響以及增加染病風險,所以若有打算用心照顧他們的話還是把這項基本參數顧好吧。
3. 測量
要談如何控制溫度前還有個重點便是測量。一般玩家很少會使用準確校正過的實驗規格溫度計,實際上當然也沒這個必要,不過我會建議最少要有三種以上的測量設備在手邊(誤差一定會有,因此重點是範圍及趨勢),並隨時關注生物表現以避免溫水煮青蛙的狀況發生。
4. 加溫
以臺灣的氣候來說其實一年中會需要加溫的日子真的不多(除非你住山上),而且一般的缸中往往也會有馬達等額外的熱源會貢獻一些熱能。最常見的加溫器材就是加溫棒,類型包含玻璃、陶瓷、及鈦製。選購時請注意加溫棒是否有溫控功能,若無則需額外使用溫控器,也可以選擇本身可溫控的加溫棒將設定溫度調至略高於目標作為保險,並使用外加溫控器來做主要的控制。不過加溫棒由於成本相對低所以算是很容易遇上品質問題的水族產品,因此長期使用時最好多注意一下是否有破損並在情況許可下盡量多上點保險(e.g. 外加溫控、使用複數根加溫棒等)。
5. 降溫
降溫對許多新入坑的玩家而言可能會是個比較大的坎,因為降溫設備多半比較不像加溫棒那樣淺顯易懂又價格低廉。常見降溫手段包含蒸發散熱、壓縮機式冷卻、及晶片式冷卻。
蒸發散熱最常見的設備便是風扇,算是價格最低廉的選擇。其表現相當受環境的溼度影響且降溫幅度也較為有限,因此多半使用在不需降太低溫的缸或是小缸並配合自動補水以補充蒸發的水量。一些戶外養殖也會採用大型的冷卻水塔提升蒸發散熱效率,但在一般居家養殖則較難以應用。
壓縮機式冷卻是一般使用範圍最廣的冷卻手法,原理就跟你家的冷氣和冰箱一樣,是利用冷媒的相態轉換來將熱排出。市面上有許多水族用的壓縮機式冷水機,缺點是若機台放置在室內其廢熱會直接往周遭排造成室溫上升;另外一個選擇是分離式冷水機,其構造基本上就是把一般分離式冷氣的室內機改成鈦管來在缸內做熱交換,好處是廢熱會排到戶外,但安裝時就得考慮到如何配置散熱管路及室外機。
晶片式冷水機是利用半導體製冷晶片以電位差產生溫差來轉移熱能。優點是設備體積及噪音都不大,但常見的市售產品往往無法處理太大的水量,因此較常被使用在50L以下的小缸。
6. 其他控溫要點
除了主動式的加溫或降溫外,也有一些額外的小技巧可以協助控溫。冬天時可以透過幫缸子加蓋的方式來減少蒸發進而維持溫度(不過也要注意氣體交換),反之盡量增加水面擾動及減少缸內熱源則可以降低一些降溫的需求。環境因素也是控溫時一個很大的考量,所以選擇缸子的位置也是一個控溫的手段。也因此像是「養海水缸需不需要冷水機?」這種問題坦白講完全沒有意義,因為同樣的缸子養在終年恆溫的空調房和風吹日曬的陽台所需的控溫設備當然不會一樣。
另外有條件的話也可以幫溫控額外上點保險,例如增加有警示功能的監控器或同時讓降溫及加溫設備在缸內待機以避免任一個突然發神經等都是常見的做法。
二、鹽度
1. 簡介
鹽度最白話的解釋就是水裡有多少鹽。鹽除了會讓水變鹹外也會影響到滲透壓(鹽度越高滲透壓越高),而這對生物來說是項很重要的因子。水會從滲透壓低的地方往高的地方流,這也是為什麼喝海水會導致脫水,因為滲透壓高於我們體液的海水反而會讓體內的水分加速流失。魚類等構造較複雜的動物會有一系列的機制來維持體內滲透壓在固定值,因此在進入滲透壓不同的環境時他們會需要一點時間來調控體內的平衡;反之像珊瑚這類構造簡單的動物則是直接讓體內滲透壓與外界一致,因此就沒有太多複雜的調控了。
鹽度同時也決定了之後會提到的絕大多參數,因為鹽度基本上可以說是水中各種東西的總和。常常會聽到有人一值無法釐清為何缸子內某項數據有異常,但最後卻是發現根本鹽度就已經跑掉了,所以在探討其他數據前請至少先將鹽度給搞定吧。
2. 維持範圍
比起鹽度,在水族界中可能會更常聽到「比重」這個詞,然而鹽度(salinity)和比重(specific gravity)雖然有一些關聯性但本質上是兩項完全不同的參數。 鹽度是濃度的計量(多少水裡有多少鹽),常用單位為ppt(每公斤的水裡有多少公克的鹽);而比重則是在一溫度下溶液和純水的密度比,也因為是比值所以不會有單位。我們通常需要的是鹽度而非比重,只是早期由於測量技術限制只能利用比重來回推該溫度下的鹽度所以常常被混為一談。
和溫度一樣,不同海域的鹽度也有可能有很大的差異,例如紅海這種半封閉海域可能會到近40ppt,而一些河口區域則可能只有30ppt。一般以珊瑚礁生物為主的缸子多半會維持在33~35 ppt這個區間,不過一些純養魚的玩家可能會將鹽度降到25~30 ppt來減少魚類維持滲透壓所需的耗能(因為海水滲透壓是高於魚類體內的)。
由於鹽度牽涉到許多其他數據,通常在選定了一個區間後就不會再做什麼變動了,且除了河口外的多數野外環境的鹽度也不太會有大幅度的波動。另外在往缸子放入新的魚類、節肢動物、軟體動物等對滲透壓變動較敏感的生物的話最好注意一下來源處的鹽度,若差異太大可能就得花多一點的時間對水(珊瑚或海葵這些就比較沒差了)。
3. 測量
唯一能直接測量鹽度的方法是將水煮乾然後秤剩下多少鹽,但這顯然並不怎麼實際,因此測量鹽度的設備多半是利用其他有關聯性的參數來回推。常用的測量方法包含比重、折射率、以及導電度,不過這些數據也都會受到溫度的影響(鹽度本身不會)因此得將這點考量到換算的公式內(也就是溫度補償)。
市售比重計大致有浮標式及指針式兩種,價格相對較低,由於是機械式測量所以使用時須注意是否有污漬或氣泡的影響造成失準;折射率測量有肉眼辨識及電子辨識兩類,使用時最好先讓水樣與環境溫度平衡30秒到1分鐘並注意設備是否為設計給海水使用以及不同溫度下不同的對照值(有些產品會有表可對,電子式則多半會內建補償換算);導電度測量的好處是方便快速,但缺點是設備的品質有不小的落差且比起其他兩者可能會需要更常校正。另外無論是使用哪種測量方式請務必確認設備有被正確維護並至少以RO水清潔過後放乾,因為除了導電度外測量鹽度時所使用的水體多半很小,因此相當容易受鹽漬或淡水的污染而影響測量。
4. 校正
比起溫度,鹽度的測量設備就好校正很多了,因此我強烈建議無論使用哪種原理的鹽度計最好都要頻繁校正。校正與歸零的概念其實不太一樣,以鹽度計而言歸零多半就是直接用淡水即可,但校正的話則最好選用與目標鹽度接近的溶液。市面上可以買到一些35 ppt的標準液,你也可以自己買電子秤及氯化鈉來配或直接去你信得過的水族館與他們的缸子對照。
5. 控制手法
如果你是使用人工海水的話基本上就是鹽度低了就加鹽然後高了就補淡水(有生物的話得注意別讓太大量的鹽在缸內一此性溶解),但天然海水就只能做稀釋或慢慢等水蒸發了(當然你要直接加海水素也行)。有些人會去計算要用多少體積或重量的鹽來調多少的鹽度,不過即使你算的很精確還是有可能因為受潮等因素影響,所以最好還是測一下做確認。
另外切記水蒸發是會提升鹽度的(鹽不會蒸發),因此補水這件事對於維持鹽度來說至關重要。若你的缸子比較沒有散熱問題的話也可以透過加蓋來減少蒸發延長補水區間(但還是得注意氣體交換別完全封死),不過除非你完全不會出遠門不然最好還是準備某種形式的自動補水。
三、pH
1. 簡介
pH在中文我們也常將其稱之為酸鹼值,代表的是溶液中氫離子和氫氧根離子的相對關係,其數值的定義為溶液中的氫離子濃度取log後乘上負號(pH中的H即為氫離子)。
如果數學都已經忘光了也沒關係,簡單來講若一溶液有10的負五次方(0.0001)莫耳濃度的氫離子,換算為pH值便會是5,也就是說pH越低氫離子濃度就越高(溶液越酸),pH越高則氫離子濃度越低(溶液越鹼),而若氫離子和氫氧根離子的濃度相等的話則稱為中性(在攝氏25度時pH=7為中性)。
pH同樣調控著諸多生物體內的生化反應,因此若偏離太多也是會影響生物的健康或直接造成死亡。此外,無論是生物性或非生物性的鈣化都會隨這pH上升而速率加快,反之pH過低則有可能反過來使碳酸鈣結構開始溶解(pH越低碳酸鈣溶解度越高),因此對於像珊瑚這類會建構碳酸鈣骨骼的生物來說pH高自然可以長得比較快,不過一些發生在馬達等設備上的鈣化也會增加所以也得注意是否影響運轉。
2. 維持範圍
海洋中的pH值平均約在8.0~8.3之間,而一般缸子如果落在7.8~8.5的範疇內我就不會太擔心了。有些玩家會刻意追求高pH來加速珊瑚的生長,不過這同時也會提升各種離子及養分等的消耗量以及增加部分毒素的毒性,因此若沒有相應做出調整甚至可能產生反效果。 二氧化碳溶於水中所形成的碳酸也是個影響pH值的重要因子,因此通常在關燈後由於光合作用(消耗二氧化碳)的減少pH也會隨之降低,不過只要都還落在合理範圍內就不用太緊張。
另外長時間運輸生物時也有可能因為在封閉包裝內碳酸堆積所造成pH降低,因此在下缸時可以注意一下袋中pH是否有掉得太誇張並視情況調整對水流程(尤其是魚蝦等構造較複雜的動物)。不過我倒是並沒有找到什麼證據表明在正常範圍內的pH變動到底有什麼影響,甚至還有部分研究認為一定程度的pH變動對珊瑚可能是有幫助的[9]。
3. 測量
常見的pH測量方式包含了指示劑以及電極。pH指示劑的成分為會隨著pH值不同而呈現不同顏色的物質,一般市售測試劑及測試紙便是利用此原理,不過缺點是其測量精度可能不太夠且也有藥劑變質及顏色分辨的問題,因此多半只會拿來粗略抓一下範圍。
如果要更精確的量測pH比較主流的方法是使用pH電極。pH電極的原理是利用溶液中氫離子的電位來推算出pH值,不過由於pH會受到溫度影響因此也是需要進行溫度補償。市面上有許多pH測量儀器可供選擇,不過選購時記得先注意一下設備適用的電極、pH範圍、以及測量目標並看看產品的溫度補償和校正功能是否符合你的需求。
電極在使用前必須被校正(平常最好也要固定校正)。常見的pH校正液包含pH4、7、10等,以一般海水缸用途而言建議選擇能以pH7或10校正液兩點校正的設備並注意校正液的使用期限。另外pH電極也是消耗品因此得定期更換,平時也需要保存在緩衝液(通常是KCl溶液)中不能讓其乾掉,而若是長期放在缸中監控的電極最好也要定時清潔避免生物或污垢附著影響測量結果(多數電極不能被擦拭故只能以純水潤洗)。
4. 控制手法
以海水缸而言其實多半只要維持好KH值(後面會介紹)pH就不會跑得太誇張了,因此也有不少玩家是完全不管pH的,而若真的想在pH上下點功夫請至少先確認你的測量結果是準確可信賴的(由於pH是取log後的結果,僅僅0.3的不同的實際上已經是近兩倍的氫離子濃度差異了)。
若是遇到pH長期偏低的情況我會先往碳酸累積的方向去思考。原因有可能是缸內有太多生物或濾材砂石在行呼吸作用產生二氧化碳、缸子所處位置的二氧化碳濃度太高(通常是室內或是人多的地方)、或是有使用鈣反等會往缸內打CO2的設備。如果是缸內問題最簡單的做法就是減少生物密度、移除一些濾材及汙泥、或是加強缸子的氣體交換(e.g. 水面擾動、蛋白機等);若是環境因素則可以嘗試開窗通風、將蛋白機的進氣引至室外。也有些人會使用二氧化碳吸附劑或藻缸來移除CO2、抑或是添加氫氧化鈣來將碳酸轉為碳酸根或碳酸氫根使其能被鈣化利用(同樣會在後面介紹),不過這些方式就得衡量一下成本或是空間是否允許。至於pH太高的狀況則較少見,多半是因為有某種添加劑或缸內的物質(e.g. 水泥)在提升pH,因此若有發生可以往這方面去注意。
另外我再補充幾個常見的誤解。首先,溶氧量和pH沒有直接關係!這個觀念應該是來自大家把呼吸作用的原料及產物概念搞混了,因為實際影響pH的是二氧化碳(產物)而非氧氣(原料);另外一項誤解是很多人會認為珊瑚砂等碳酸鈣材質的底質能提升pH,然而這些材質頂多就是做為一點緩衝,對pH接近8的海水缸而言並沒有太多提升的作用,而且隨著生物膜、有機物、以及鎂離子等附著在表面上這些砂石會在幾個月內失去大半的緩衝能力,甚至反而有可能因為裡頭的大量微生物不斷呼吸產生二氧化碳及各種生物作用產生的酸化而對pH有負面的影響[17]。
四、KH
1. 簡介
一般我們講的KH比較準確的說法應該叫做「鹼度」,而KH這個稱呼則是來自於鹼度的德制單位dKH(deutsche Karbonathärte),其定義為溶液對酸的緩衝能力,也就是說當溶液的鹼度越高就需要越多的酸才能降低其pH。鹼度通常是由許多有緩衝能力的離子如 HPO4 2-、 PO4 3-、H2BO3- 、HCO3-、CO3 2-等一起貢獻的而非單一一種離子,不過在海水中最主要的貢獻者是碳酸(H2CO3)、碳酸氫根離子(HCO3-)、以及碳酸根離子(CO3 2-)這三兄弟,也因此KH又有「碳酸鹽硬度」這個稱呼(也就是dKH的德語意思)。這三者之間為共軛酸鹼對的關係,也就是說它們能藉由丟出或接收氫離子的方式來互相轉換,而所謂的pH緩衝效果也是由此而來(等於說多了一個倉庫來存放氫離子)。

(來源: https://www.researchgate.net/public...of_ocean_acidification_on_marine_biodiversity)
了解了緩衝系統後應該就能理解為何前面會說只要顧好KH就不用太擔心pH了,然而除此之外KH對缸中生物而言還有許多影響。首先,鈣化作用在形成碳酸鈣時也會消耗碳酸鹽。上圖為珊瑚在分泌碳酸鈣骨骼時的過程,可以看到其原料便是鈣離子和碳酸氫根,並且由於過程中還要排除氫離子故水體pH越高鈣化的效率也會越好(如同前面在pH那邊所提的)。
此外,碳酸氫根對於很多自營生物來說也是一項可利用的無機碳源(Dissolved Inorganic Carbon, DIC) 。很多自營生物例如植物、藻類、硝化菌等都能利用碳酸酐酶(Carbonic anhydrase)將碳酸氫根轉換為 CO2 利用,這也是為什麼大家常說老缸子的旺盛的硝化

(來源:https://www.researchgate.net/publication/266077973_Response_of_benthic_foraminifera_to_ocean_acidification_and_impact_on_Florida's_carbonate_sediment_production)
上圖為不同pH值時碳酸鹽系統的平衡比例,可以看到在一般海水pH值時比例最高的是碳酸氫根,而多數生物也是以它為主要利用對象
2. 維持範圍
除了dKH外,鹼度也常被以meq/L(當量)或ppm(碳酸鈣濃度)來表示,但為求方便我基本上都會用dKH來介紹。
KH在天然海水中大約落在6~7dKH,然而究竟要維持缸子的KH在什麼數據每個人可能都有不同的習慣,一般比較常見的數據多半在7~11dKH之間。過低的KH除了會減緩鈣化及光合作用外也會使pH更容易變動。反之較高的KH則能加速光合作用及鈣化的效率使珊瑚等生物長得比較快[10, 12],但由於生物性與非生物性的鈣化速率都會增加因此除了KH消耗外也得注意鈣的消耗以及碳酸鈣沉澱。另外也有不少玩家回報若缸中的營養鹽濃度偏低的話高KH(>9)有可能造成Acropora等珊瑚出現分枝頂端脫皮的狀況(俗稱燒頂)但其機制尚未完全明瞭,不過如果擔心的話也可以將KH維持在7~8dKH的範圍就好[1]。
此外也有許多人會去追求KH的穩定。這大方向來說我不覺得有什麼問題,畢竟在一個成熟的系統中KH確實是個消耗量很大又容易變動的參數,但我倒不認為有必要徹底鎖在一個固定值上。穩定是一個長期的趨勢,若是整天在數據上鑽牛角尖反而還更容易出亂子。我自己是習慣大概抓1dKH的範圍,比如7~8或9~10,只要測出來有在範圍內就行了。
3. 測量
最常見的KH測量方式是利用滴定法。其原理簡單來說就是利用到達特定pH就會變色的酸鹼指示劑或是pH電極來測量樣本pH,然後再往樣本裏頭開始滴定某種酸,等到pH到達目標後停止並記錄加了多少酸,若是加越多就代表KH越高(緩衝能力越強)。另外也有一些設備會反過來把加入的酸固定並看pH改變多少來計算KH(例如HANNA或KHG的比色法)或是直接量樣本與大氣平衡後的pH並用空氣CO2含量來回推KH(如KHA)。
KH通常比較少人會刻意準備標準液來校正,但我還是會建議至少偶爾用剛泡好的海水等大致知道範圍的溶液稍微檢查一下並注意pH電極的維護(若是用電極測量的話),而如果是使用自動測量的設備也最好定時手測一下做個對照。
4. 控制手法
由於碳酸氫根很容易被生物消耗,多數缸子的KH會需要某種補充的方式,以下我會分別做個簡單的介紹。
(1) 換水
如果你的缸子很小可以頻繁的大量換水或是你得生物對KH的需求及要求沒那麼高的話換水也是一個可行的做法(也有一些人會選擇高KH的海水素來減少換水的比例),不過若缸子或生物消耗量大到一定程度的話基本上就不太可能靠換水維持住適當的KH了。
(2) 碳酸鈉(蘇打)&碳酸氫鈉(小蘇打)
這個方法應該是最直觀也最泛用的,許多市售的KH補充劑其實也只是這兩種鹽類的水溶液,因此若想省錢的話也可以直接買原料加,不過就得注意藥品的品質及純度。碳酸鈉與碳酸氫鈉的差別在於前者在添加時有短暫提升pH的效果,因此若有pH偏低的狀況也可以做為輔助。另外若添加頻率較高的話也可以用滴定(蠕動馬達)自動添加,不過要注意得盡量和其他金屬離子添加劑(如氯化鈣)同時添加避免沉澱,且若長期使用可能會導致鈉離子的累積因此得適當換水來稀釋。
(3) 氫氧化鈣
氫氧化鈣的原理是利用氫氧根去與缸內既有的碳酸結合形成碳酸氫根提升KH。氫氧化鈣同時也能補充鈣離子及提升pH,不過添加時得注意不能一次加太大量以避免pH驟升使碳酸鈣沉澱(就白加了),而且由於氫氧化鈣的溶解度不高所以也得小心別加超過一天的蒸發量。另外添加氫氧化鈣時多半加入的是混合後的澄清溶液,而這可以透過事先混好等溶液沉澱或是使用鈣水攪拌器來達成,並且要盡量避免儲存的溶液及粉末與空氣接觸而與二氧化碳形成碳酸鈣導致效果降低。
(4) 鈣反應器
鈣反應器的原理是將缸內水導入一裝有珊瑚砂等碳酸鈣材質的密閉容器中並往裡頭打CO2降低pH將碳酸鈣溶回碳酸氫根和鈣離子(和鈣化反過來),因此與氫氧化鈣一樣能同時補充KH和鈣但卻會反過來降低pH。鈣反應器多半使用在石珊瑚密度很高的大型缸,因為它的耗材本身的成本最低(碳酸鈣&CO2),但由於調整及操作都較多細節要注意且初始設置成本高故多半是較有經驗的玩家在使用。
(5) 甲酸鈣&乙酸鈣
部分市售產品如TM All For Reef(甲酸鈣)或Salifert All In One(乙酸鈣)就是使用這個方法。這兩種鹽類補充KH的方式是透過缸內的微生物作用將甲酸根或乙酸根氧化為碳酸氫根,並且可同時補充鈣,不過由於需經過微生物作用故KH提升效果並不會馬上出現而且過程中也會耗氧並產生CO2降低pH(基本上也是一種有機碳源)。
(6) 降KH
KH過高的情形則多半只要慢慢等生物消耗降下來即可,不過若真的有急需的話一般會使用鹽酸,但請注意個人及生物的安全。KH過高的除了添加過多或水源問題外最常見的大概就是缸子裡有水泥製品;另外若有大量硝酸鹽被還原時(脫氮作用或細菌、藻類藻類等的同化作用)KH也可能上升,不過這狀況就比較少見了[11]。
五、鈣離子(Ca)
1. 簡介
鈣離子在神經傳導、調控酵素活性等諸多基礎生化作用中都扮演著很重要角色,但在海水缸中我們最常提到的用途便是鈣化。
珊瑚、軟體動物、節肢動物等動物的外殼或骨骼成分有很大一部分就是碳酸鈣(我們脊椎動物的硬骨則是磷酸鈣),因此維持水體中足夠的濃度(鈣離子&碳酸氫根離子)自然相當重要,尤其是許多海洋生物又會比起淡水生物還更仰賴從環境吸收這些原料。
2. 維持範圍
海洋中的鈣離子濃度大致在380ppm~480ppm之間,而一般的海水缸也多半會選擇維持在這個範圍。
鈣的濃度和KH一樣和鈣化速度有一定的關係[13],不過高濃度的鈣也會增加沉澱機率以及使KH的維持變得困難;至於過低的鈣濃度除了影響珊瑚等鈣化生物的成長外也有可能使蝦蟹等節肢動物發生脫殼不順的狀況。
3. 測量
市面上多數的鈣離子測試劑的原理是先利用某種會和鈣離子結合變色的指示劑與樣本中的鈣結合變色,接著再以EDTA等螯合劑滴定去把指示劑上的鈣搶走讓其顏色變回來,然後再看滴了多少螯合劑變色來推斷鈣濃度。這個測試方法其實和鎂離子測試劑以及淡水常用到的GH測試劑幾乎是一樣的原理,差別只是在要怎麼排除測試目標以外的金屬離子的影響。也有一些使用比色法的產品是透過修改不同的螯合劑及指示劑來達到效果,不過基本邏輯還是一樣。例如Hanna便是使用zincon method讓樣本中的鈣去替換掉測試劑中EGTA上的鋅,並改成以與鋅結合會變色的物質做指示劑來看有多少鋅被換出來。
另外市面上也有一些鈣離子測試儀器是利用離子選擇性電極直接測量溶液中鈣離子的電勢,如Pinpoint和Hanna都有類似的產品,不過由於價位較高相對就比較少玩家使用了。
4. 控制手法
換水、氫氧化鈣、鈣反、甲酸鈣&乙酸鈣等同時補充KH及鈣的方法我在上面已經提過了所以就不多做贅述。
至於單獨提升鈣離子的方法最常見的就是使用氯化鈣,不過若是以原料添加的話同樣須注意品質、別與碳酸鈉or碳酸氫鈉一起加、適當換水避免氯離子過度累積、並看一下你用的是無水還是含水的氯化鈣(添加量會不太一樣)。
六、鎂離子(Mg)
1. 簡介
鎂離子同樣參與了許多生化作用,而在海水缸中它主要會被光合作用以及鈣化過程消耗。葉綠素的基本結構中就包含了鎂,因此藻類等光合作用生物生長時自然會需要其作為原料;另外雖然比例遠不及鈣但許多生物在鈣化時也是會把鎂一起併入骨骼,例如鈣藻在生長時相對其他鈣化生物就會使用更多的鎂。
除了單純的生物性鈣化外鎂還有另一項很重要的功能,那就是維持海水中碳酸鈣的過飽和狀態。海水中的碳酸鈣濃度若在一般狀況下其實早該沉澱了,不過之所以沒有發生最大的原因便是鎂離子。鎂離子的角色有點類似電燈泡,當鈣離子與碳酸根或碳酸氫根形成碳酸鈣結晶時鎂也會一起黏到表面上阻止更進一步的結晶發生,因此若你發現缸子裡的鈣及KH怎麼拉都拉不起來的話有可能就是鎂太低導致加進去的鈣及碳酸鹽都直接沉澱掉了。
2. 維持範圍
海洋中的鎂離子濃度通常會落在1200ppm~1300ppm,而在海水缸中有時會維持的稍微高一點(1200ppm~1500ppm)來增加緩衝。過低濃度的鎂離子除了會增加維持KH和鈣的難度外,也有一些玩家發現特定種類的珊瑚(如一些Montipora)的健康狀況可能會受影響[3]。
3. 測量
常見的鎂離子測試劑的原理基本上和多數鈣離子測試劑差不多,也是利用螯合劑與指示劑的搭配來行滴定法,但由於EDTA等螯合劑對鈣離子的親和能力較強故多半得透過不同的方式排除鈣離子的影響,不過也是可以反過來利用這點以螯合劑處理掉鈣離子後在單純以指示劑的變色狀況來做比色法。
4. 控制手法
補充鎂離子常用的藥品為氯化鎂及硫酸鎂,而使用注意事項則和上述其他添加劑相同(無水氯化鎂由於溶解時會放出大量的熱故較少被使用)。
七、總氨(NH3/4+)
1. 簡介
這裡的總氨指的是水體中分子態氨(NH3)與離子態的銨根離子(NH4+)的總和,算是在水族飼養中最常被提及的毒素之一。
幾乎所有生物在代謝胺基酸或蛋白質時都會產生氨,不過氨對於生物體多半具有毒性,因此得想辦法將其排除。我們哺乳類多半是在肝臟將氨轉化為毒性較低的尿素再隨泌尿系統排出,而魚等水生生物或構造簡單的生物則通常是直接利用擴散作用排出氨。缸子裡的殘餌、大便、或死亡生物的屍體會造成水體汙染的主因也因為這些東西多半含有不少含氮有機物,所以隨著被環境中的各種微生物分解便會產生氨。
水體中的氨多半會以毒性較低的銨根離子的形式存在,不過NH3及NH4+之間的比例是受到pH決定的,pH越高NH3的比例就越高。pH在小於7時所有的氨都會轉為銨根離子故在酸性水中幾乎不太需要擔心氨的毒害,然而在鹼性的海水中氨的毒性就會大增了。
2. 維持範圍
海洋中的總氨濃度多半會在0.1ppm以下。至於在穩定的養殖系統中,氨則基本上是不太應該被一般的肉眼比色型測試劑測到。
不同生物對氨的耐受性不太一樣。 若實際從氨的毒性機制來看,環境中低濃度的氨最主要影響是魚類等生物的鰓,造成上面的離子運輸異常與黏膜增生降低表面積而使其缺氧;不過如果是像珊瑚這類構造簡單的生物反而不容易被氨傷到,因為牠們沒有有鰓這種為了呼吸特化的超高表面積器官,甚至連血液與循環系統都沒有,僅僅只靠簡單的擴散作用處理物質運輸,甚至在適當的濃度下還能將其作為養分吸收利用。
3. 測量
常見的總氨測試劑是利用次氯酸根與酚和氨形成藍綠色化和物後進行比色,另外也有一些市售的電子設備能分別測試NH3或NH4+。不過要注意使用的方法量的究竟是離子態、分子態、還是總氨,進行換算則須將pH也考慮進來。
4. 控制手法
利用微生物的硝化作用來處理氨算是水族箱中最常被提到的手法。除此之外植物、藻類、細菌、甚至珊瑚等生物也都可以將銨根離子作為氮源吸收(甚至還有人會以氯化銨或氨水人工添加),因此在穩定的老缸中多半就比較不會去關注這項數據了。
另外淡水缸中常用的吸氨沸石等離子交換濾材在海水中幾乎沒有任何作用,因為海水中有超高濃度的鈉鉀離子競爭,所以對於低濃度的銨很難發揮到交換的效果。
八、亞硝酸鹽(NO2)
1. 簡介
亞硝酸鹽或是說亞硝酸根離子是硝化作用的中間產物,雖然同樣具有毒性不過在海水中由於高濃度的氯離子影響所以在一般海水缸中幾乎很難毒害到生物。
亞硝酸根是藉由魚類平衡滲透壓的氯細胞(chloride cell/ionocyte)穿透鰓進入魚體,並在血液中與血紅素結合,使血液運送氧的能力下降。不過海水魚的氯細胞類型與淡水魚不太一樣,主要負責的是將體內氯離子向外丟(淡水魚的氯細胞則主要是負責攝入氯離子),所以亞硝酸鹽自然就難以跟著氯離子進入海水魚體內了。
2. 維持範圍&控制手法
在穩定的缸子中亞硝酸鹽基本上也不太應該被測出來,不過假使有什麼突發狀況導致亞硝酸鹽上升的話倒也不用太緊張因為這東西在海水中根本很難弄死生物,把重心放在氨還比較實際。
3. 測量
常見的亞硝酸鹽的測量方法為利用磺胺與亞硝酸根行重氮反應後再與N-(1-Naphthyl)ethylenediamine形成偶氮染料做比色法。
九、硝酸鹽(NO3)
1. 簡介
硝酸鹽為硝化作用的最終產物,比起常被當作毒素看待的氨和亞硝酸鹽,硝酸鹽最常被討論的反倒是其作為養分與肥料的角色,而一般我們提到營養鹽或NP時多半也就是指硝酸鹽及磷酸鹽(銨及亞硝酸鹽其實也算營養鹽)。
2. 維持範圍
海洋中的硝酸鹽通常會在1ppm以下(依地區而異),但不同玩家的海水缸硝酸鹽濃度就有很大的差異了。從低到無法以測試劑測得一路到接近100ppm的誇張濃度我有都見過能將多數生物養的不錯的缸子,不過多數人比較能接受的範圍大致會在20ppm以下。
目前的研究對於硝酸鹽等營養鹽對不同生物的上限值到底在哪裡以及究竟會有什麼直接的生理影響其實也還沒有個定論[14],不過我也並不建議去追求這些極端數值,畢竟不同生物的適應能力多少也有差。高濃度硝酸鹽對生物的影響目前已知的多半是比較間接性的,例如加速缸內的藻類或其他微生物的生長或是使珊瑚的共生藻增加影響顏色等。
至於多低的硝酸鹽才是太低則是取決於你缸內是否有其他類型的養分。珊瑚確實是會藉由共生藻來間接利用硝酸鹽等營養鹽,但這不代表這是他們唯一的養分獲取手段。如果你所飼養的生物(這邊主要是指珊瑚)可以透過直接餵食等方式獲得所需的養分的話那水體中的營養鹽濃度可能就不是那麼重要了;反之如果其他的養分來源不足的話那水體中過低的營養鹽就有可能影響到健康了。
不過測試劑無法測得也不見得代表你缸中營養鹽就一定不足。測試劑的靈敏度問題當然是一個可能性,不過另一種狀況是你缸中營養鹽在產出後馬上就被生物用掉了所以不會在水中停留太久,因此當缸內營養鹽處於低標時生物的狀況可能就會比實際的數值更有參考意義,但如果真的很擔心見底的話也是可以把濃度先維持在至少測試劑還測得出來的程度。
3. 測量
市售硝酸鹽測試劑其實也就只是亞硝酸鹽測試劑再加上鎘粉或鋅粉等還原劑將硝酸鹽還原回亞硝酸鹽,不過也是因為這個原理所以當水中有亞硝酸鹽存在時硝酸鹽測試劑就會失準,因此測試前可以稍微注意一下這點(通常是新缸比較會有這種狀況)。
4. 控制手法
由於多數化學性的濾材吸收硝酸鹽的效率都不太好所以常見的降硝酸鹽手段幾乎都是生物性的。比較直接的方法是依靠藻類或細菌的同化作用讓他們直接吸收硝酸鹽做為肥料,例如藻缸、藻屏、或是添加有機碳源等;或者是利用微生物的脫氮作用將硝酸鹽還原回氧氣與氮氣,例如各式硝酸鹽化除器或是加厚的底沙。
不過其實當缸內有一定密度的珊瑚、餵食量也不過量的話往往也足以讓硝酸鹽維持在很低的數值了,甚至在很多情況下還會需要稍微拉抬濃度。要拉高硝酸鹽其中一個方式就是加強餵食,讓含氮的食物被生物利用代謝後自然轉換為硝酸鹽;或者要更直接一點也可以用硝酸鉀或硝酸鈉等鹽類來人工補充。
十、磷酸鹽(PO4)
1. 簡介
磷和氮一樣都是組成生物體的基本元素,我們的DNA和RNA等遺傳物質、細胞的能量貨幣ATP(adenosine triphosphate)等也都有磷的成分。
我們一般統稱的磷酸鹽算是一系列無機磷的統稱,其中包含了 H3PO4、H2PO4-、HPO4 2-、PO4 3-。磷酸鹽和硝酸鹽一樣也是我們常說的營養鹽之一,因此同樣可被生物作為養分吸收利用,不過水體中可測得的無機磷其實也只占整體磷含量的一部分,其中很多的磷可能是以有機化合物的形式存在或是吸附在其他物質上面(磷酸根很喜歡黏東西)。
磷酸鹽的來源除了含磷有機物在缸中被分解外也常經由水源進入缸中,尤其台灣的自來水往往有不低的磷酸鹽濃度,甚至有些區域即使有使用RO膜也不見得能完全去除。
2. 維持範圍
海洋中的磷酸鹽濃度多半在0.01ppm以下(這邊主要是以PO4 3-為來計算),不過就和硝酸鹽一樣在海水缸中也常看到各式各樣亂七八糟的濃度,而多數人都比較能接受的範圍大致是0.1ppm以下。
磷酸鹽與硝酸鹽一樣若濃度高有可能造成缸內的藻類、微生物、及珊瑚的共生藻增加,不過還有另一項常被討論的是其對鈣化的影響。確實是有研究發現磷酸鹽會影響到鈣化過程,不過對珊瑚來說究竟是正面還是負面的影響其實也還未有個結論, 例如Dunn等人比較了Acropora muricata(長枝)在0.09、0.2、以及0.5ppm的磷酸鹽下的生長,結果發現在0.5ppm下珊瑚的生長速度最快但骨骼密度則有下降,除此之外也沒有觀察到什麼不健康的狀況[15]。至於過低的狀況則和硝酸鹽差不多所以我就不再重複一遍,如果擔心見底的話就一樣維持在測試劑可測得的狀態吧。
3. 測量
市售磷酸鹽測試劑多半採用鉬藍法,其原理為讓磷酸根和鉬酸鹽結合後再以抗壞血酸(維生素C)還原為藍色化和物行比色法。不過由於磷酸鹽在海水缸中一般都維持在相對低的濃度故一般的肉眼比色恐怕很難分辨0.1ppm以下的濃度,因此若希望針對你的數值做任何調整的話最好還是要有比色儀。
4. 控制手法
市面上可以買到很多磷酸鹽吸附劑,其中最常見的成分為氧化鐵(GFO)以及氧化鋁(GAO)。也有些玩家會添加氯化鑭來與磷酸鹽形成沉澱物後以物理過濾濾除,不過這個方法很容易使磷酸鹽快速見底且沉澱物若沒有妥善濾除也可能卡到魚的鰓造成窒息,因此除非你的磷酸鹽真的非常高不然我個人並不推薦將其作為長期維持的方案。而生物性的除磷法主要依賴同化作用,方法則如上面在硝酸鹽那邊所提。另外若在短期內降低磷酸鹽的話最好注意一下KH的消耗,因為無機磷系列的東西同樣也是鹼度的重要組成。
如果是想拉升過低的磷酸鹽的話則一樣可透過增加餵食或以磷酸鉀或磷酸鈉等鹽類補充,不過要注意一下有些單純的胺基酸添加劑對磷酸鹽的增加其實並沒有幫助(生物體內常見胺基酸的結構並不含磷)。
延伸閱讀
如果搞懂了這些參數的意義後想再進一步了解一些細節的話這裡還有一些文章可以參考看看
飼養資料整理
添加劑計算機:
海缸小幫手APP
無機鹽類計算機
KH、鈣、鎂添加計算機
微生物作用:
一些微生物作用的簡介
[基礎觀念]關於硝化系統的一些迷思與誤解
結語
這篇文章的主要目的其實也只是希望能讓人稍微多了解一點數字背後的基本原理。當然也不用搞得像個化學家,但能知道自己的缸子內正在發生什麼事或是加進去的東西到底是幹啥的不也是挺酷的嗎?
似乎有不少人都對「化學」這個詞很反感,也許是各種食安新聞導致的PTSD吧。人往往會對不瞭解的事物心生恐懼,進而產生許多亂七八糟的謠言,而這也是我認為科普很重要的其中一個原因。雖然基礎科學對多數人而言可能比應用科學無聊不少,畢竟比起推陳出新的科技產品這些老知識可能幾百年來都始終如一,然而所謂的創新其實也還是得建立在扎實的基礎上。有時會看到一些入坑根本還沒一兩年的新手就開始在那邊討論什麼氮磷平衡、微量元素、或是菌種競爭之類的東西。當然也不是說不能談啦,但講真的這些主題都可以寫好幾篇博士論文了,如果真的想探討的話起碼先把一些最基礎的東西先鑽研透徹吧。
另外還有一個給新手的小建議那就是不要太過追求數字!雖然我在這邊還是都有附上建議的維持範圍,但以上數據中真的會因為偏離範圍而直接造成生物掛掉的其實也就只有溫度、鹽度、pH、氨這四項而已。這意思當然不是說其他就都不用管了(如果是這樣我也不會寫這篇了......),只是很多時候真正引發災難其實並不是你發現的問題本身而是你急於改善所做出的行動,因此了解原理以及冷靜分析非常重要。如果真的發現了數據不甚理想,我最先會注意的會是生物的狀況,再來才會是去釐清問題所在(也完全有可能是測量問題),而不是看到OO太高就趕快加XX劑。多數生物的適應能力其實遠比我們想得還強,而且即使是海洋也並非所有地方都有一樣的數值,甚至很多環境的震盪幅度還比我們的缸子大,所以也不見得有什麼完美的數據,只有適合你的缸子的數據。
參考資料
1. Optimal Parameters for a Coral Reef Aquarium by Randy Holmes-Farley
2. Saltwater Aquarium Chemistry: How To Supplement Calcium And Alkalinity by Randy Holmes-Farley
3. How To Grow The Most INTENSE Purple Rim Monti Cap by Jake Adams
4. Daily Average Ocean Water Temperatures Against Long Term Average Water Temperature Australian Institute of Marine Science
5. Standard Methods for the Examination of Water and Wastewater
6. Hennige, Sebastian & Roberts, J. & Williamson, Phillip & Aze, T & Barry, J & Bellerby, Richard & Brander, Luke & Byrne, Maria & Gattuso, Jean-Pierre & Gibbs, S & Hansson, Lina & Hattam, Caroline & Hauton, C & Havenhand, Jon & Fosså, JH & Kavanagh, Christopher & Kurihara, Haruko & Matear, Richard & Mark, Felix & Young, Jeremy. (2014). An updated synthesis of the impacts of ocean acidification on marine biodiversity. CBD Technical Series, 75, 1-99.
7. Knorr, Paul. (2014). Response of benthic foraminifera to ocean acidification and impact on Florida's carbonate sediment production.
8. Oliver, T.A., Palumbi, S.R. (2011). Do fluctuating temperature environments elevate coral thermal tolerance? Coral Reefs, 30, 429–440.
9. Comeau, Steeve & Edmunds, Peter & Spindel, Nathan & Carpenter, RC. (2014). Diel pCO2 oscillations modulate the response of the coral Acropora hyacinthus to ocean acidification. Marine Ecology Progress Series. 501. 99-111.
10. Marubini Francesca, Thake Brenda. (1999). Bicarbonate addition promotes coral growth. Limnology and Oceanography, 3.
11. Brewer Peter G. , Goldman Joel C. (1976). Alkalinity changes generated by phytoplankton growth. Limnology and Oceanography, 1.
12. Herfort, L., Thake, B. and Taubner, I. (2008). Bicarbonate stimulation of calcification and photosynthesis in two hermatypic corals. Journal of Phycology, 44, 91-98.
13. Alan T. Marshall, Peta L. Clode. (2002). Effect of increased calcium concentration in sea water on calcification and photosynthesis in the scleractinian coral Galaxea fascicularis. J Exp Biol, 205 (14): 2107–2113.
14. M. C. Buckingham, C. D'Angelo, T. B. Chalk, G. L. Foster, Z. Connelly, C. Olla, M. Saeed & J. Wiedenmann. (2022). Impact of nitrogen (N) and phosphorus (P) enrichment and skewed NP stoichiometry on the skeletal formation and microstructure of symbiotic reef corals. Coral Reefs 41, 1147–1159.
15. Jeremy G. Dunn, Paul W. Sammarco, Gary LaFleur. (2012). Effects of phosphate on growth and skeletal density in the scleractinian coral Acropora muricata: A controlled experimental approach. Journal of Experimental Marine Biology and Ecology, 411, 34-44.
16. J. Charles Delbeek, Julian Sprung. (2005). The Reef Aquarium: Science, Art, and Technology. Miami Gardens, FL: Ricordea Publishing.
17. Stephen Spotte. (1991). Captive Seawater Fishes: Science and Technology. Wiley-Interscience.
最後編輯: